Allentare le misure e favorire una immunità acquisita nelle giovani generazioni, dove il Covid-19 decorre in maniera quasi asintomatica, può aiutare a ottenere prima l’immunità di gregge? Uno dei tanti studi prodotti negli Usa sta diventando virale in Europa, parliamo di un articolo pubblicato sulla rivista Science
Ricercatori della Emory e della Penn State University, Stati Uniti d’America, rilanciano l’idea che dovremo imparare a convivere con il virus Sars-Cov-2 senza esagerare con le chiusure, considerando che questo nemico tornerà a ripresentarsi a ondate, con alti e bassi più o meno marcati legati all’alternanza delle stagioni, fino a confondersi una volta per tutte, come avviene per il comune raffreddore.
Gli esseri umani, questo l’assunto di partenza, sono sempre stati esposti ad agenti infettivi, epidemie che provocano una sorta di selezione naturale.
“Negli ultimi decenni – scrivono gli autori Jennie Lavine, Ottar N. Bjornstad e Rustom Antia – l’umanità ha affrontato molteplici sfide da infezioni virali acute, tra cui sindrome respiratoria acuta grave (SARS), sindrome respiratoria mediorientale (MERS), Ebola eccetera, tutti focolai subito circoscritti. Ma se la situazione sfugge di mano, come è successo nel caso del nuovo Coronavirus, occorre comprendere e pianificare la transizione verso un modello di comportamento diverso, che considera il virus endemico, cioè ineliminabile”.
Quindi, detto in altri termini, se non riapriamo questa pandemia finirà tra vent’anni. Al contrario, più lasciamo il virus libero di circolare, prima lo sconfiggeremo, a patto ovviamente di proteggere le fasce più esposte e vulnerabili, come gli anziani e persone con più patologie.
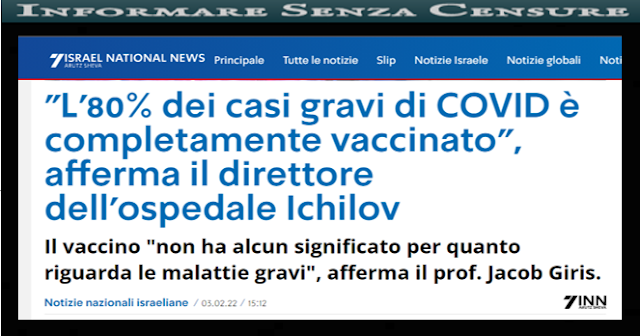
Tutto ciò è stato gia detto da scienziati veri non quelli nostrani politicizzati a cui viene data parola dai media mainstream che di conseguenza ripetono a cantile il pensiero unico della dittatura sanitaria.....
Coronavirus, BASTA LOCKDOWN! L’appello di medici, epidemiologi e scienziati di tutto il mondo...“Dichiarazione di Great Barrington” contro le attuali misure anti-Covid
https://informaresenzacensure.blogspot.com/2020/10/coronavirus-basta-lockdown-lappello-di.html
STUDIO DELL’UNIVERSITÀ DI STANFORD: IL LOCKDOWN E LE MISURE RESTRITTIVE NON HANNO NESSUN FONDAMENTO SCIENTIFICO
https://informaresenzacensure.blogspot.com/2021/02/studio-delluniversita-di-stanford-il.html
Sotto lo studio tradotto in italiano....
- Jennie S. Lavine 1 , * ,
- Visualizza il profilo ORCIDOttar N. Bjornstad 2 ,
- Visualizza il profilo ORCIDPersonalizza Antia 1
Visualizza tutti gli autori e le affiliazioni
vol. 371, numero 6530, pagg. 741-745
DOI: 10.1126 / science.abe6522
Domare una pandemia
Un anno dopo la sua comparsa, la sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2) è diventata così diffusa che ci sono poche speranze di eliminazione. Esistono, tuttavia, molti altri coronavirus umani che sono endemici e causano reinfezioni multiple che generano un'immunità sufficiente per proteggere da gravi malattie degli adulti. Facendo ipotesi sull'immunità acquisita dai suoi parenti già endemici, Lavine et al.ha sviluppato un modello con cui analizzare la traiettoria di SARS-CoV-2 in endemicità. Il modello tiene conto del profilo della malattia strutturato per età di SARS-CoV-2 e valuta l'impatto della vaccinazione. Il passaggio dalle dinamiche epidemiche a quelle endemiche è associato a uno spostamento nella distribuzione per età delle infezioni primarie ai gruppi di età più giovani, che a sua volta dipende dalla velocità di diffusione del virus. L'immunità sterilizzante più duratura rallenterà la transizione verso l'endemicità. A seconda del tipo di risposta immunitaria che genera, un vaccino potrebbe accelerare l'instaurarsi di uno stato di endemicità lieve della malattia.
Scienza , questo numero p. 741
Astratto
Attualmente ci troviamo di fronte alla questione di come la gravità dell'infezione con la sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2) possa cambiare negli anni a venire. La nostra analisi dei dati immunologici ed epidemiologici sui coronavirus umani endemici (HCoV) mostra che l'immunità che blocca le infezioni diminuisce rapidamente ma che l'immunità che riduce la malattia è di lunga durata. Il nostro modello, che incorpora questi componenti dell'immunità, ricapitola sia l'attuale gravità dell'infezione da SARS-CoV-2 sia la natura benigna degli HCoV, suggerendo che una volta raggiunta la fase endemica e l'esposizione primaria è nell'infanzia, SARS-CoV-2 può essere non più virulento del comune raffreddore. Prevediamo un risultato diverso per un coronavirus emergente che causa una grave malattia nei bambini. Questi risultati rafforzano l'importanza del contenimento comportamentale durante il lancio del vaccino pandemico,
ISCRIVITI A SCIENCE eTOC
Ricevi l'ultimo numero di Science direttamente a te!
Gli esseri umani sono stati regolarmente minacciati da patogeni emergenti che uccidono una parte sostanziale di tutte le persone nate. Gli ultimi decenni hanno visto molteplici sfide da infezioni virali acute, tra cui sindrome respiratoria acuta grave (SARS), sindrome respiratoria mediorientale (MERS), Hendra, Nipah ed Ebola. Fortunatamente, tutti erano contenuti localmente. Quando il contenimento non ha successo immediato, come è probabile per la nuova sindrome respiratoria acuta grave da betacoronavirus coronavirus 2 (SARS-CoV-2) ( 1 , 2 ), è necessario comprendere e pianificare la transizione verso l'endemicità e la circolazione continua, con possibile cambiamenti nella gravità della malattia dovuti all'evoluzione del virus e all'accumulo di immunità e resistenza dell'ospite.
SARS-CoV-2 è un virus emergente che causa COVID-19. Il virus ha un numero riproduttivo di base elevato ( R 0 ) ed è trasmissibile durante la fase asintomatica dell'infezione, cosa che ne rende difficile il controllo ( 3 ). Tuttavia, ci sono altri sei coronavirus con catene di trasmissione umane note, che potrebbero fornire indizi su scenari futuri per l'attuale pandemia. Esistono quattro coronavirus umani (HCoV) che circolano endemicamente in tutto il mondo; questi causano solo sintomi lievi e non rappresentano un notevole onere per la salute pubblica ( 4). Altri due ceppi di HCoV, SARS-CoV-1 e MERS-CoV, sono emersi negli ultimi decenni e hanno rapporti di mortalità per casi più elevati (CFR) e rapporti di mortalità per infezione (IFR) più elevati rispetto a COVID-19 ma erano contenuti e quindi non si sono mai diffusi ampiamente ( 5 , 6 ).
Proponiamo un modello per esplorare i potenziali cambiamenti sia nella trasmissione che nella gravità della malattia degli HCoV emergenti attraverso la transizione verso l'endemicità. Ci concentriamo su SARS-CoV-2 e discutiamo di come le conclusioni sarebbero diverse per i coronavirus emergenti più simili a SARS-CoV-1 e MERS-CoV. La nostra ipotesi è che tutti gli HCoV suscitino un'immunità con caratteristiche simili e l'attuale problema acuto di salute pubblica è una conseguenza dell'emergenza epidemica in una popolazione immunologicamente naïve in cui i gruppi di età più avanzata senza precedente esposizione sono più vulnerabili a malattie gravi. Usiamo le nostre stime dei parametri immunologici ed epidemiologici per gli HCoV endemici per sviluppare un modello quantitativo per la trasmissione endemica di un virus con caratteristiche simili alla SARS-CoV-2, inclusa la dipendenza dall'età della gravità.
Basandosi sulle idee tratte dalla letteratura sui modelli di vaccini, suggeriamo che l'immunità possa fornire protezione in tre modi ( 7 ). Nella sua forma più robusta, l'immunità sterilizzante può impedire a un agente patogeno di replicarsi, rendendo così l'ospite refrattario alla reinfezione. Chiamiamo questa proprietà efficacia immunitaria rispetto alla suscettibilità (IE S ). Se l'immunità non impedisce la reinfezione, può comunque attenuare la patologia dovuta alla reinfezione (IE P ) e / o ridurre la trasmissibilità o l'infettività (IE I ). Infatti, studi sperimentali di riesposizione su HCoV endemici forniscono la prova che le tre efficacia immunitarie non diminuiscono alla stessa velocità ( 8 , 9 ). Callow et al.Lo studio sperimentale di ( 8 ) mostra che la reinfezione è possibile entro un anno (IE S relativamente breve ); Tuttavia, dopo reinfezione, i sintomi sono lievi (alta IE P ) e il virus viene cancellato in modo più rapido (moderata IE I ). Dettagli sulla derivazione del modello possono essere trovati nella sezione 2 dei materiali supplementari (SM).
Rianalizziamo un set di dati dettagliato che stima la sieroprevalenza specifica per età sulla base sia dell'immunoglobulina M (IgM; risposta acuta) che dell'IgG (memoria a lungo termine) contro tutti e quattro gli HCoV circolanti nei bambini e negli adulti ( 10 ) per stimare gli intervalli dei parametri per la trasmissione e il declino dell'immunità ( Fig. 1A). Il rapido aumento della sieroprevalenza sia IgM che IgG indica che l'infezione primaria con tutti e quattro i ceppi endemici di HCoV si verifica all'inizio della vita e la nostra analisi di questi dati ci fornisce una stima dell'età media dell'infezione primaria (MAPI) tra 3,4 e 5,1 anni, con quasi tutti infettati da 15 anni (vedere la sezione 1 SM per i dettagli). L'assenza di titoli IgM rilevabili in qualsiasi individuo di età superiore ai 15 anni suggerisce che la reinfezione degli adulti provoca una risposta di richiamo, indicando che mentre l'immunità specifica per l'HCoV può diminuire, non è persa. Se l'immunità scenderà a livelli ingenui in assenza di un'elevata circolazione di patogeni rimane una questione aperta.
( A ) Proporzione media sieropositiva per IgG (verde, linee superiori) e IgM (viola, linee inferiori) contro i quattro ceppi endemici di HCoV [punti collegati da linee tratteggiate; le linee verticali rappresentano l'intervallo di confidenza al 95% (CI); dati da ( 10 )]. L'età media dell'infezione primaria (MAPI) basata sui dati IgM con IC al 95% è mostrata nell'inserto di ciascun pannello (vedere SM per i dettagli). ( B ) MAPI in funzione del declino dell'immunità sterilizzante ω ( asse y ) e della trasmissibilità delle reinfezioni ρ ( asse x ). La MAPI è stata calcolata dalle dinamiche di equilibrio del modello mostrato in fig. S1 ed equazioni supplementari da 3 a 9 con un numero riproduttivo di base plausibile ( R 0= 5), 0 <ω <2 e 0 <ρ <1. Vedere la sezione 2.1 di SM per i dettagli. Il riquadro mostra le combinazioni plausibili di valori di ρ e ω coerenti con la MAPI per HCoV stimata in (A). FOI, forza dell'infezione; I 2 , reinfezione. [Vedi fig. S1 per cifre parallele calcolate a valori estremamente plausibili per R 0 (cioè, R 0 = 2 e 10).]
Affinché la maggior parte delle persone venga infettata così presto nella vita, persino più giovane del morbillo nell'era pre-vaccino, il tasso di attacco deve superare la trasmissione dalle sole infezioni primarie. Il modello mostra che un alto tasso di attacco può derivare da una combinazione di alta trasmissibilità da infezioni primarie (cioè, alto R 0 ), declino dell'immunità sterilizzante e trasmissione sostanziale da reinfezioni in individui più anziani. Il rapido declino dell'immunità sterilizzante è riportato anche nelle infezioni sperimentali da HCoV degli esseri umani, che hanno dimostrato che la reinfezione è possibile 1 anno dopo un'infezione precedente, anche se con sintomi più lievi (IE P ) e una durata più breve (IE I ) ( 8 ). Figura 1Bmostra le combinazioni plausibili di immunità decrescente e trasmissione da individui reinfettati che sono necessarie per produrre la MAPI osservata nella Fig. 1A , sulla base dei livelli di infezione allo stato stazionario (vedere la sezione 2.1 di SM per i dettagli). La tabella 1 mostra gli intervalli dei parametri utilizzati nelle nostre simulazioni.
Caratteristiche delle interazioni coronavirus-immunità e intervalli di parametri rilevanti.
All'inizio di un'epidemia, la distribuzione per età dei casi rispecchia quella della popolazione ( Fig. 2A ). Tuttavia, una volta che i dati demografici dell'infezione raggiungono uno stato stazionario, il nostro modello prevede che i casi primari si verificano quasi interamente nei neonati e nei bambini piccoli, che, nel caso di COVID-19, sperimentano un CFR basso e un IFR contemporaneamente basso. Si prevede che le reinfezioni negli individui più anziani siano comuni durante la fase endemica e contribuiscano alla trasmissione, ma in questa popolazione allo stato stazionario, gli individui più anziani, che sarebbero a rischio di malattia grave da un'infezione primaria, hanno acquisito l'immunità che riduce la malattia dopo infezione durante l'infanzia. Il pannello superiore della Fig. 3B illustra come l'IFR complessivo per SARS-CoV-2 diminuisce drasticamente, scendendo infine al di sotto di quello dell'influenza stagionale (~ 0,001) una volta raggiunto lo stato stazionario endemico.
Transizione dalla dinamica epidemica a quella endemica per gli HCoV emergenti, simulata da un'estensione del modello presentato in fig. S1 che include la struttura per età. Le caratteristiche demografiche (distribuzione per età, nascita e tassi di mortalità specifici per età) sono ricavate dagli Stati Uniti e la stagionalità è incorporata tramite una funzione di forzatura sinusoidale (vedere SM sezione 2.2). Il debole distanziamento sociale è approssimato da R 0 = 2. (Vedere le figure da S9 a S11 per risultati di forte distanziamento sociale, R 0 <1.5.) ( A ) Numero giornaliero di nuove infezioni (linea nera; calcoli nella sezione SM 2.3). Un picco iniziale è seguito da uno stato endemico a bassa incidenza (anni da 5 a 10 mostrati nel riquadro). Un R 0 maggioresi traduce in un'epidemia iniziale più ampia e più rapida e in una transizione più rapida alle dinamiche endemiche. La proporzione di casi primari in diversi gruppi di età cambia nel tempo (tracciata in diversi colori) e il passaggio dalle dinamiche epidemiche a quelle endemiche si traduce in casi primari limitati a gruppi di età più giovani. Parametri per le simulazioni: ω = 1 e ρ = 0.7. ( B ) Tempo in cui l'IFR medio (media mobile a 6 mesi) scenda a 0,001, che è l'IFR associato all'influenza stagionale. Le aree grigie rappresentano simulazioni in cui l'IFR non ha raggiunto 0,001 entro 30 anni. Il tempo per IFR = 0,001 diminuisce al diminuire della trasmissibilità ( R 0) aumenta e la durata dell'immunità sterilizzante si riduce. I risultati sono mostrati per ρ = 0.7. Vedere la sezione 2.3 SM e le figg. Da S4 a S7 per analisi di sensibilità e specifiche del modello.
La dipendenza dall'età dell'IFR determina come l'IFR complessivo cambia durante la transizione dalle dinamiche epidemiche a quelle endemiche per gli HCoV emergenti. ( A ) Dipendenza dall'età degli IFR per i tre HCoV emergenti. Le infezioni primarie da MERS-CoV e SARS-CoV-1 sono costantemente sintomatiche e pertanto si presume che IFR e CFR siano gli stessi. SARS-CoV-1 e SARS-CoV-2 hanno profili a forma di J, con un aumento monotono dell'IFR con l'età. L'IFR specifico per età per MERS-CoV è a forma di U, con elevata mortalità sia nei gruppi di giovani che in quelli di vecchiaia. I dettagli del livellamento statistico sono descritti nella sezione 6 del SM ( B) L'IFR complessivo cambia durante la transizione alle dinamiche endemiche. Questi calcoli presumono che i decessi dovuti a reinfezioni siano trascurabili. Rilassiamo questa ipotesi per consentire un più lento accumulo di immunità e possibile morte a causa di infezione secondaria nei fichi. S5 a S9 e mostrano che i risultati qualitativi non cambiano.
Il tempo necessario per completare il cambiamento in IFR man mano che si sviluppa l'endemicità dipende sia dalla trasmissione ( R 0 ) che dalla perdita di immunità [declino dell'immunità sterilizzante (ω) e trasmissibilità delle reinfezioni (ρ)], come mostrato in Fig. 2B e fig. . S4. Il passaggio dalle dinamiche epidemiche a quelle endemiche è associato a uno spostamento nella distribuzione per età delle infezioni primarie verso i gruppi di età inferiore ( Fig. 2A ). Questa transizione può richiedere da pochi anni a pochi decenni, a seconda della velocità con cui l'agente patogeno si diffonde. Il tasso di diffusione, misurato da R 0 , è determinato da una combinazione di proprietà virali e dalla frequenza dei contatti sociali e può quindi essere ridotto dall'allontanamento sociale. Il pannello superiore inLa Fig. 2A mostra l'effetto della riduzione di R 0 a 2, mentre i pannelli centrale e inferiore mostrano le dinamiche per R 0 più alto , che sono più simili a quelle di SARS-CoV-2 in assenza di misure di controllo. Se la trasmissione è alta, il modello prevede un elevato carico di casi e un alto tasso di mortalità negli anni precedenti dopo l'emergenza ( Fig. 2 e Fig. S5). Vediamo che, come ci si potrebbe aspettare, un'immunità sterilizzante più duratura rallenta la transizione verso l'endemicità ( Fig. 2B ). Questi risultati sono robusti per una distribuzione più biologicamente realistica per la durata dell'immunità sterilizzante e per la possibilità che la generazione dell'immunità protettiva richieda più di un'infezione (vedere SM sezione 3 e figure da S5 a S9).
Rallentare l'epidemia attraverso misure di allontanamento sociale che riducono R 0 vicino a 1 appiattisce la curva, ritardando così le infezioni e prevenendo la maggior parte dei decessi precocemente, offrendo un momento critico per lo sviluppo di un vaccino efficace (fig. S10). Se l' immunità IE S e IE P indotta dal vaccino è simile a quella indotta dalle infezioni da HCoV, il vaccino può inaugurare il regime endemico più rapidamente. Il codice modello (vedere i riconoscimenti) fornisce un'impalcatura flessibile per lo studio di scenari di vaccinazione alternativi. In particolare, il modello prevede che una volta raggiunto lo stato endemico, la vaccinazione di massa potrebbe non essere più necessaria per salvare vite umane (vedi SM sezione 4 e fig. S11).
Possiamo estendere le nostre previsioni ad altre due infezioni potenzialmente emergenti da coronavirus, SARS e MERS. Il nostro modello prevede che nello stato endemico, l'IFR di un HCoV circolante dipende principalmente dalla gravità delle infezioni infantili. Nel caso di SARS-CoV-1, che è più patogeno di SARS-CoV-2, ci aspettiamo ancora un basso carico di malattia nella fase endemica, perché SARS-CoV-1, come SARS-CoV-2, ha un basso IFR nei giovani ( Fig.3 ). Tuttavia, i dati suggeriscono che non tutti gli HCoV emergenti seguono questo modello ottimistico; l'IFR complessivo di un virus endemico simile alla MERS non diminuirebbe durante la transizione verso l'endemicità, come si vede nella Fig. 3B, e questo perché la gravità della malattia (e IFR) è elevata nei bambini, il gruppo di età che ci si aspetta sperimenterà la maggior parte dei casi primari durante la fase endemica. Nella fase endemica, sarebbe quindi necessario un programma di vaccinazione contro la MERS per evitare un eccesso di mortalità (fig. S11).
Il risultato chiave del nostro modello di struttura che riconosce esplicitamente che l'immunità funzionale alla reinfezione, alla malattia e alla diffusione è diversa è che, in contrasto con le infezioni che sono gravi durante l'infanzia, SARS-CoV-2 potrebbe unirsi ai ranghi di lieve, freddo HCoV endemici a lungo termine. Una previsione critico è che la gravità HCoVs emergenti volta raggiunta endemicity dipende solo dalla gravità dell'infezione nei bambini ( Fig. 3 ), in quanto tutte le prove disponibili suggeriscono che l'immunità a HCoVs ha breve IE S e moderare IE io , portando a frequenti reinfezione durante l'età adulta ( 11 , 12 ), ma forte IE Ptale che l'infezione infantile fornisce protezione dalla patologia in caso di reinfezione in età adulta, come evidenziato dalla rarità di infezioni gravi o titoli di IgM rilevabili negli adulti. Fattori di virulenza ceppo-specifici, quali il recettore cellulare condivisa, inibitori dell'enzima di conversione 2 (ACE-2), al quale SARS-CoV-1, SARS-CoV-2, e il ceppo endemico NL63 tutti bind ( 13 - 16 ) , può influenzare il CFR durante la fase di emergenza ma avere un impatto minimo sulla gravità della malattia nella fase endemica. Poiché i quattro HCoV endemici circolano a livello globale da molto tempo e quasi tutti sono infetti in giovane età, non possiamo accertare quanta patologia deriverebbe da un caso primario o addirittura secondario di uno di questi in una persona anziana o altrimenti vulnerabile .
Le intuizioni chiave derivano dal modo in cui il nostro modello incorpora esplicitamente diversi componenti della protezione immunologica rispetto a suscettibilità, patologia e infettività (IE S , IE P e IE I , rispettivamente) e le loro diverse velocità di diminuzione. Nella nostra analisi, abbiamo ipotizzato che questi componenti dell'immunità per SARS-CoV-2 siano paragonabili a quelli degli HCoV endemici e questo deve essere determinato. Inoltre, durante la transizione verso l'endemicità, dobbiamo considerare come l'efficacia immunitaria dipenda dalle infezioni primarie e secondarie attraverso le età ( 17 ) e come le risposte differiscano tra vaccinazione e infezione naturale.
L'analisi longitudinale dei pazienti con SARS offre l'opportunità di misurare la durata della memoria immunitaria in assenza di riesposizione. L'unico studio a lungo termine di cui siamo a conoscenza che segue gli anticorpi specifici per SARS-CoV-1 suggerisce che diminuiscono più velocemente degli anticorpi contro altri virus vivi e vaccini come morbillo, parotite, rosolia e vaiolo ( 18 ) e scendono al di sotto della soglia di scoperta in 6 anni ( 19 ). Contrariamente alle risposte anticorpali, le cellule T della memoria persistono per periodi molto più lunghi ( 19 , 20 ) e conferiscono protezione nei sistemi modello animale ( 21 ).
Consideriamo inoltre gli effetti della variazione del ceppo sia per l'infezione naturale che per la vaccinazione. La variazione del ceppo e la fuga di anticorpi possono verificarsi nei ceppi endemici ( 22 ); tuttavia, il fatto che i sintomi siano lievi suggerisce che l'immunità indotta da ceppi visti in precedenza è comunque abbastanza forte da prevenire malattie gravi. In effetti, tra gli HCoV, le frequenti reinfezioni sembrano aumentare l'immunità contro i ceppi correlati ( 12 ). Tuttavia, l'effetto della variazione del ceppo può differire per l'immunità indotta dal vaccino, specialmente alla luce del più ristretto repertorio di epitopi di molti vaccini attualmente autorizzati.
Se è necessario un frequente potenziamento dell'immunità mediante la circolazione virale in corso per mantenere la protezione dalla patologia, allora potrebbe essere meglio che il vaccino imiti l'immunità naturale nella misura in cui previene la patologia senza bloccare la circolazione del virus in corso. I risultati preliminari suggeriscono che il vaccino a base di adenovirus è migliore nel prevenire infezioni gravi rispetto a quelle lievi o asintomatiche ( 23) e sarà importante raccogliere dati simili per gli altri vaccini. Se il vaccino dovesse causare una forte riduzione della trasmissione, potrebbe essere importante considerare strategie che mirino alla consegna a individui più anziani per i quali l'infezione può causare una maggiore morbilità e mortalità, consentendo al contempo il mantenimento dell'immunità naturale e della trasmissione negli individui più giovani. Durante la transizione verso l'endemicità, le infezioni primarie da SARS-CoV-2 si verificheranno frequentemente negli individui più anziani e dobbiamo determinare se l'immunità indotta dall'infezione o dalla vaccinazione nell'età adulta è simile a quella prodotta dalle infezioni naturali nell'infanzia. Finora, sono state segnalate poche reinfezioni da SARS-CoV-2 e la gravità della malattia è variata ( 24); l'unico studio sulla reinfezione a livello di popolazione di cui siamo a conoscenza stima un basso tasso di reinfezione nei primi 6 mesi dopo l'infezione primaria e una malattia lieve dopo la reinfezione ( 25 ), ma ulteriori analisi e monitoraggio sono vitali.
I risultati presentati qui suggeriscono che l'uso dei sintomi come strumento di sorveglianza per frenare la diffusione di SARS-CoV-2 diventerà più difficile, poiché le reinfezioni più lievi contribuiscono sempre più alle catene di trasmissione e ai tassi di attacco a livello di popolazione. Inoltre, l'infezione o la vaccinazione possono proteggere dalle malattie ma non fornire il tipo di immunità di blocco della trasmissione che consente la schermatura ( 26 ) o la generazione di immunità di mandria a lungo termine ( 2 ).
I dettagli della variazione dell'IFR complessivo durante il periodo transitorio saranno influenzati da un'ampia gamma di fattori, come i tassi di contatto umano specifici per età ( 27 ) e la suscettibilità alle infezioni ( 28 ), nonché il miglioramento dei protocolli di trattamento, la capacità ospedaliera e l'evoluzione del virus. Il risultato qualitativo della malattia lieve nella fase endemica è robusto a queste complessità, ma le previsioni quantitative per la fase transitoria dipenderanno da un'attenta considerazione di queste realtà e dal modo in cui interagiscono con le dinamiche dell'infezione e le componenti dell'immunità ( 29 ).
I cambiamenti nell'IFR nel tempo previsti dal modello hanno implicazioni per la strategia di vaccinazione contro gli HCoV emergenti attuali e futuri. Il distanziamento sociale e un vaccino efficace sono fondamentali per il controllo durante un'epidemia vergine e la transizione da essa, ma una volta entrati nella fase endemica, la vaccinazione di massa potrebbe non essere più necessaria. La necessità di una vaccinazione continua dipenderà dalla dipendenza dall'età dell'IFR. Se le infezioni primarie dei bambini sono lievi (come per SARS-CoV-1 e SARS-CoV-2), la vaccinazione continua potrebbe non essere necessaria poiché i casi primari regrediscono a lievi tiri di naso infantili. Se, d'altra parte, l'infezione primaria nei bambini è grave (come per la MERS), sarà necessario continuare la vaccinazione dei bambini.
Da una prospettiva ecologica ed evolutiva, il nostro studio apre la porta a domande riguardanti le dinamiche all'interno e tra l'ospite dell'immunità umana e delle popolazioni patogene di fronte all'efficacia immunitaria con cinetiche diverse. Apre anche la questione di come queste efficacia immunitarie interagiscano con l'immunità crociata del ceppo, che è probabilmente rilevante all'interno degli alfa e dei betacoronavirus. La considerazione dei dati e delle previsioni del modello dall'emergenza attraverso l'endemicità degli HCoV ha rivelato un quadro per la comprensione dell'immunità e della vaccinazione che possono applicarsi a una varietà di infezioni, come il virus respiratorio sinciziale e l'influenza stagionale, che condividono distribuzioni di età e risposte immunitarie simili.







Nessun commento:
Posta un commento