Astratto
Le malattie autoimmuni, tra cui la sclerosi multipla e il diabete mellito di tipo 1, colpiscono circa il 5% della popolazione mondiale. Nell'ultimo decennio, si sono accumulati segnalazioni su varie patologie autoimmuni, quali porpora da trombocitopenia idiopatica, miopardite, insufficienza ovarica primitiva e lupus eritematoso sistemico (LES), in seguito a vaccinazione. In questa recensione, discutiamo i possibili meccanismi sottostanti di reazioni autoimmuni in seguito a vaccinazioni e riesaminano i casi di malattie autoimmuni che sono stati correlati con la vaccinazione. Il mimetismo molecolare e l'attivazione di astanti sono riportati come possibili meccanismi con cui i vaccini possono causare reazioni autoimmuni.
Ulteriori ricerche sono incoraggiate nelle associazioni dirette tra vaccini e condizioni autoimmuni, e i meccanismi biologici dietro di loro.
Parole chiave: Vaccino, Medicina preventiva preventiva personalizzata, Profilo del paziente individualizzato, Diabete, Sclerosi multipla, Test genetico
Nonostante la propaganda "Astroturfing" mediatica globale foraggiata da oscuri interessi per promuovere i farmaci vaccini e nascondere ai nuovi consumatori "obbligati" le loro reazione avverse. Le reazioni autoimmuni alle vaccinazioni possono essere indotte in individui predisposti da meccanismi di attivazione di mimetismo molecolare o astante.
Nel post troverete anche uno studio tutto italiano del 2017 che veniva pubblicato proprio in concomitanza all'approvazione della legge liberticida e incostituzionale (119/2017).
2018
Autoimmunità indotta da vaccino: il ruolo del mimetismo molecolare e della crossreazione immunitaria.
Astratto
Sin dai primi anni del 1800 i vaccini hanno salvato numerose vite prevenendo le infezioni letali. Tuttavia, negli ultimi due decenni, c'è stata una crescente consapevolezza dei possibili eventi avversi associati alle vaccinazioni, coltivando dibattiti accesi e portando a significative fluttuazioni nei tassi di vaccinazione. È quindi pertinente per la comunità scientifica affrontare seriamente l'interesse pubblico degli effetti avversi dei vaccini per riguadagnare la fiducia del pubblico in questi importanti interventi medici. Tali reazioni avverse ai vaccini possono essere viste come risultato dell'interazione tra suscettibilità del soggetto vaccinato e vari componenti del vaccino. Tra i meccanismi implicati per queste reazioni c'è il mimetismo molecolare. Il mimetismo molecolare si riferisce a una significativa somiglianza tra alcuni elementi patogeni contenuti nel vaccino e specifiche proteine umane. Questa somiglianza può portare ad una crossreattività immunitaria, in cui la reazione del sistema immunitario verso gli antigeni patogeni può danneggiare le proteine umane simili, causando essenzialmente una malattia autoimmune. In questa recensione, affrontiamo il concetto di mimetismo molecolare e la sua applicazione nella spiegazione dei fenomeni autoimmuni post vaccinazione. Esaminiamo ulteriormente i principali esempi di vaccini contro l'influenza, l'epatite B e il virus del papilloma umano, tutti sospettati di indurre autoimmunità tramite mimetismo molecolare. Infine, ci riferiamo a possibili implicazioni sul potenziale sviluppo futuro di vaccini migliori e più sicuri. in cui la reazione del sistema immunitario verso gli antigeni patogeni può danneggiare le proteine umane simili, causando essenzialmente una malattia autoimmune. In questa recensione, affrontiamo il concetto di mimetismo molecolare e la sua applicazione nella spiegazione dei fenomeni autoimmuni post vaccinazione. Esaminiamo ulteriormente i principali esempi di vaccini contro l'influenza, l'epatite B e il virus del papilloma umano, tutti sospettati di indurre autoimmunità tramite mimetismo molecolare. Infine, ci riferiamo a possibili implicazioni sul potenziale sviluppo futuro di vaccini migliori e più sicuri. in cui la reazione del sistema immunitario verso gli antigeni patogeni può danneggiare le proteine umane simili, causando essenzialmente una malattia autoimmune. In questa recensione, affrontiamo il concetto di mimetismo molecolare e la sua applicazione nella spiegazione dei fenomeni autoimmuni post vaccinazione. Esaminiamo ulteriormente i principali esempi di vaccini contro l'influenza, l'epatite B e il virus del papilloma umano, tutti sospettati di indurre autoimmunità tramite mimetismo molecolare. Infine, ci riferiamo a possibili implicazioni sul potenziale sviluppo futuro di vaccini migliori e più sicuri. epatite B e vaccini contro il papilloma umano, tutti sospettati di indurre autoimmunità tramite mimetismo molecolare. Infine, ci riferiamo a possibili implicazioni sul potenziale sviluppo futuro di vaccini migliori e più sicuri. epatite B e vaccini contro il papilloma umano, tutti sospettati di indurre autoimmunità tramite mimetismo molecolare. Infine, ci riferiamo a possibili implicazioni sul potenziale sviluppo futuro di vaccini migliori e più sicuri.
Tratto da: https://www.ncbi.nlm.nih.gov/pubmed/29503439
2017
Vaccinazioni e malattie autoimmuni: la prevenzione degli effetti negativi sulla salute all'orizzonte?
introduzione
2017
Nel ventesimo secolo, la vaccinazione è la prevenzione più efficace delle malattie infettive epidemiologiche, come la poliomielite, il morbillo, la parotite e la rosolia [ 1 ]. Finora, sono stati concessi sul mercato oltre 70 vaccini contro circa 30 agenti infettivi: la polio, per esempio, è scomparsa dagli Stati Uniti nel 1979 dopo una vaccinazione diffusa [ 2 , 3 ].
Sebbene i vaccini siano generalmente sicuri, con una bassa incidenza di eventi avversi sistemici gravi, numerosi studi hanno evidenziato l'insorgenza di sindrome neurologica (sindrome di Guillain Barre, sclerosi multipla, autismo), articolare (artrite, artrite reumatoide) e autoimmuni spiacevoli (lupus sistemico eritematoso, diabete mellito) dopo procedure singoli o combinati multivaccino (tabella (Tabella 1)1 ) [ 4 ].
Tabella 1
Malattie autoimmuni riportate dopo la vaccinazione
| Malattia autoimmune | Tipo di vaccino | arbitro |
|---|---|---|
| Lupus eritematoso sistemico | HBV, tetano, antrace | [ 17 ] |
| Artrite reumatoide | HBV, tetano, tifo / parathypoid, MMR | [ 18 ] |
| Sclerosi multipla | HBV | [ 19 - 21 ] |
| Artrite reattiva | Influenza BCG, tifo, DPT, MMR, HBV | [ 22 - 24 ] |
| Polimiosite / dermatomiosite | BCG, vaiolo, difterite, DPT | [ 22 , 25 ] |
| Poliarterite nodosa | Influenza, pertosse, HBV | [ 22 , 25 ] |
| Sindrome di Guillain Barre | Influenza, poliomielite, tetano | [ 26 - 28 ] |
| Diabete mellito di tipo I | HIB | [ 29 - 31 ] |
| Trombocitopenia idiopatica | MMR, HBV | [ 22 , 25 ] |
| Tiroidite di Hashimoto | HBV | [ 32 ] |
Nel 1994, Stratton e colleghi hanno pubblicato il primo rapporto su una relazione causale tra diversi vaccini (ad esempio, difterite, tossoidi tetanici, vaccini antipolio orale) e disordini autoimmuni (ad es., Sindrome di Guillain-Barre, diabete di tipo 1 e sclerosi multipla) [ 5 ].
Queste malattie autoimmuni (malattie reumatiche, endocrinologiche e gastrointestinali) sono aumentate significativamente negli ultimi 30 anni e colpiscono oltre il 5% delle persone in tutto il mondo all'età dei programmi di vaccinazione, che è molto diversa rispetto all'incidenza spontanea della malattia autoimmune [ 6 - 9 ]. Queste osservazioni sollevano il problema se la vaccinazione debba essere raccomandata o evitata nei pazienti con rischio autoimmune [ 10 ].
L'eziologia e il meccanismo di attivazione delle malattie autoimmuni sono ancora poco chiari [ 11 ], ma diversi studi suggeriscono che un componente vaccinale (agente virale / batterico inattivo o microrganismo vivente attenuato) o un agente infettivo sovrapposto selvaggio può indurre una malattia autoimmune in persone con un predisposizione [ 12 , 13 ]. Per esempio, Borrelia burgdorferi e streptococco emolitico di gruppo A contenuti nella malattia di Lyme e nei vaccini di S. pyogenes possono causare artrite cronica e malattie cardiache reumatiche, rispettivamente [ 14 , 15 ].
La reazione autoimmune a specifici auto-antigeni può essere specifica del tessuto (come la tiroide, le β-cellule del pancreas), dove gli specifici antigeni tissutali sono mirati, o sistemici, con più tessuti interessati, e una varietà di autoantigeni espressi sono mirato [ 2 ].
I principali meccanismi patogenetici della malattia autoimmune sono i seguenti: (1) Mimetismo molecolare mediante il quale agenti virali o batterici innescano una risposta immunitaria contro autoantigeni: l'ospite sensibile è infettato da un agente che trasporta antigeni immunologicamente simili agli antigeni dell'ospite, ma innesca una diversa risposta immunitaria risposta quando presentata alle cellule T. Di conseguenza, la tolleranza agli autoantigeni si interrompe e la risposta immunitaria patogeno-specifica causa danni ai tessuti [ 11 , 16]; (2) Attivazione di bystander mediante la quale gli agenti microbici rilasciano auto-antigeni sequestrati dal tessuto ospite che attivano cellule presentanti l'antigene (APC) e cellule T helper autoreattive dormienti. Queste cellule T auto-reattive, insieme ai macrofagi, secernono citochine e un effetto additivo determina l'infiammazione locale e il reclutamento di ulteriori cellule T-helper.
Vaccino influenzale e sindrome di Guillain-Barrè
La sindrome di Guillain-Barré (GBS) colpisce i nervi periferici, con conseguente debolezza muscolare e perdita dei riflessi, in 2-8 casi ogni 100.000 persone-anno, principalmente maschi [ 33 , 34 ]. È stato rilevato dopo infezioni del tratto gastrointestinale o del tratto respiratorio superiore, virus dell'herpes [ 8 ], virus di Epstein-Barr [ 9 ], citomegalovirus [ 10 ], morbillo [ 11 ] e anche vaccinazione; che esprime anticorpi autoimmuni (compresi i gangliosidi GM1, GD1a, GT1b e GQ1b) che interagiscono con gli epitopi sui nervi periferici, portando a demielinizzazione e danno ai nervi [ 35 - 38 ]. Circa il 20-30% dei casi di GBS è positivo aMarcatori sierologici di Campylobacter jejuni [ 39 , 40 ]. Più raramente Haemophilus influenzae tipo b (Hib) e infezioni respiratorie o altre microbiche mostrano un tasso di incidenza di 0,6-4 / 100.000 persone / anno in tutto il mondo; Il GBS è stato anche legato al tempo con diverse somministrazioni di vaccini, come rabbia, poliomelite, tetano, Bacillus Calmette-Guerin (BCG), vaiolo, parotite, rosolia, epatite B e difterite [ 25 ]. Tuttavia, l'associazione tra GBS e vaccino antinfluenzale è più sorprendente. Nachamkin e colleghi che usano il vaccino "influenza dell'influenza suina A (H1N1)" su 20 topi si presume che la responsabilità di contaminanti, come i complessi di acido sialico-emoagglutinina (HA), o C. jejuniantigeni che mimano il ganglioside GM1, portando agli anticorpi specifici del titolo alto dopo l'inoculazione. Nel 1976, infatti, la campagna di vaccinazione H1N1 è improvvisamente caduta negli Stati Uniti a causa di un aumento, entro 6 settimane, di 500 casi di GBS (inclusi 25 decessi) oltre 45 milioni di vaccinati [ 41 ]. Laski et al. [ 27 ] hanno registrato un aumento del 2% dei casi di GBS per milione di persone vaccinate e anche nel programma di vaccinazione antinfluenzale (1992-1993).
Hoshino et al. (2012) hanno riportato il primo caso clinico di encefalomielite acuta disseminata (ADEM) e GBS associato alla vaccinazione H1N1 in un uomo di 36 anni [ 42 ]. L'uomo ha sviluppato ritenzione urinaria acuta , debolezza, intorpidimento degli arti e difficoltà a camminare nei 10 giorni successivi all'inoculazione del vaccino. Sono stati rilevati anticorpi anti-GM2 positivi, che si trovano frequentemente in GBS associati all'infezione da citomegalovirus [ 43 ]. Inoltre, Terryberry et al. [ 44] ha esaminato il livello di proteina del liquido cerebrospinale (CSF) (range normale 125-150 mg / L) che è sempre elevato (> 400 mg / L) nei pazienti con GBS per la presenza di anticorpi contro 18 autoantigeni della mielina. Questi risultati suggeriscono un'eziologia multiinfettiva di GBS o un'aumentata suscettibilità dei pazienti con GBS alle infezioni, supponendo che il GBS sia probabilmente una malattia autoimmune sia umorale che cellulare indotta dall'infezione con più microrganismi [ 45 ].
Diversi meccanismi potrebbero spiegare questo risultato: (1) Gli epitopi di un vaccino potrebbero avviare lo sviluppo di anticorpi e / o cellule T che potrebbero reagire in modo incrociato con epitopi su glicoproteine mieliniche o assonali; (2) La distruzione delle membrane assonali o mieliniche potrebbe essere dovuta direttamente dal virus vaccinale o dai prodotti associati al vaccino; (3) Possibile suscettibilità genetica [ 42 , 46 , 47 ] potrebbe essere lo sfondo. Ad oggi, non ci sono studi epidemiologici che affrontano la questione del rischio di sviluppo di GBS dopo la vaccinazione, si consiglia di ritardare l'immunizzazione per un breve periodo (ad es. Un anno) in tutti i pazienti con una precedente malattia neurologica (specialmente dopo tossoide del tetano) [ 48 ].
Vaccino influenzale e diabete
Il diabete di tipo 1 è una malattia autoimmune organo-specifica caratterizzata dalla distruzione selettiva delle cellule beta pancreatiche. La patologia mostra una diminuzione della massa di β-cellule con infiltrazione di cellule mononucleate nei nidi di Langerhans [ 49 ].
Attualmente, circa 15 milioni di persone, specialmente bambini piccoli, sono affetti e gli studi epidemiologici hanno evidenziato un aumento dell'incidenza del diabete mellito di tipo 1 nei paesi sviluppati, tra popolazioni geneticamente simili (ad esempio gemelli monozigoti), supponendo che i fattori ambientali giochino un ruolo processo [ 50 - 52 ].
Studi osservazionali stabiliscono un legame temporale tra le vaccinazioni infantili e lo sviluppo del diabete di tipo 1. Presumibilmente, qualsiasi vaccinazione dopo l'età di 2 mesi aumenta il rischio di diabete di tipo 1 ma, se praticata nel primo mese di vita, protegge dal diabete di tipo 1 [ 53 , 54 ].
I ricercatori hanno rilevato un'incidenza più bassa di diabete di tipo 1 nelle popolazioni immunizzate con il vaccino con bacillo Calmette-Guerin alla nascita [ 55 ], mentre altri hanno riscontrato una maggiore incidenza della malattia nei bambini che hanno ricevuto quattro dosi di vaccino Hib a 3, 4, 6, e 14 mesi di età rispetto a quelli che hanno ricevuto una dose di vaccino Hib a 14 mesi [ 55 ]. Inoltre, 21.421 bambini che hanno ricevuto il vaccino coniugato Hib (USA, 1988-1990) sono stati seguiti per 10 anni e il rischio di sviluppo del diabete di tipo 1 è stato di 0,78 rispetto a un gruppo di 22.557 bambini che non hanno ricevuto il vaccino [ 55]. Hviid e colleghi hanno confrontato l'incidenza del diabete di tipo 1 nei vaccini pediatrici abitualmente somministrati (inclusi Hib, difterite, tetano, poliovirus, pertosse, morbillo, parotite e rosolia) in una coorte di 740 bambini nati (nati nel range 1990-2000) [ 56]. Il diabete di tipo 1 è stato diagnosticato in 681 bambini che hanno ricevuto almeno una dose di vaccino, rispetto ai bambini non vaccinati, con il conseguente rapporto di frequenza: 0,91 per il vaccino Hib; 1,02 per il vaccino contro la difterite, il tetano e il poliovirus inattivato; 1,06 per il vaccino contro la pertosse a cellule intere; 1,14 per il vaccino contro il morbillo, la parotite e la rosolia; e 1,08 per il vaccino orale a base di poliovirus. Gli autori hanno scoperto che il rischio di diabete di tipo 1 aumenta tra i bambini che hanno avuto uno o più fratelli con diabete, supponendo inoltre che qualsiasi associazione tra vaccinazione e diabete di tipo 1 sarebbe più pronunciata tra i bambini geneticamente predisposti al diabete. Classen e collaboratori hanno suggerito che i tempi della vaccinazione potrebbero essere significativi e che alcuni vaccini,29 , 57 ]. Tuttavia, questa ipotesi non è stata confermata da uno studio di follow-up di 10 anni su oltre 100.000 bambini finlandesi coinvolti in una sperimentazione clinica del vaccino Hib [ 30 ]. In questo studio, non vi era alcun aumento del rischio di diabete quando i bambini che avevano ricevuto quattro dosi di vaccino a 14-18 mesi, rispetto a coloro che hanno ricevuto una singola dose a 2 anni [ 58 - 59 ]. Inoltre, il rischio di diabete non differiva tra i bambini nelle ultime due coorti e quelli in un gruppo non vaccinato non concomitante.
Nella tabella Table2,2 , abbiamo riportato una sintesi degli studi epidemiologici, recensito da specifico comitato scientifico, l'associazione tra vaccino contro l'influenza ed esacerbazione di malattia autoimmune.
Tavolo 2:
Riassunto degli studi epidemiologici sulla relazione tra vaccino influenzale e malattie autoimmuni
| Digitare il vaccino | Studio di progettazione | pazienti | Risultati: dimensione dell'effetto primario stimata (95% CI o valore p) | arbitro |
|---|---|---|---|---|
| Studi inclusi nel peso dell'evidenza epidemiologica del vaccino influenzale e della neurite ottica | ||||
| Vaccino antinfluenzale | Studio di controllo dei casi | -108 pazienti con neurite ottica | O per l'insorgenza di neurite ottica in qualsiasi momento dopo la vaccinazione antinfluenzale: 1,2 (IC 95%, 0,6-2,3) | [ 60 ] |
| Studio di controllo dei casi | -1.131 pazienti con neurite ottica | O per insorgenza di neurite ottica entro 18 settimane dalla vaccinazione antinfluenzale: 1,01 (IC 95%, 0,79-1,29) | [ 61 ] | |
| -3,393 controlli | ||||
| Studi inclusi nel peso dell'evidenza epidemiologica del vaccino influenzale e della SMR in adulti | ||||
| Vaccino antinfluenzale | Studio controllato in doppio cieco, randomizzato | -49 vaccinati | Differenza significativa nella ricaduta della SM entro 28 giorni o 6 mesi dalla vaccinazione antinfluenzale | [ 62 ] |
| -54 ricevuto placebo | ||||
| Studio controllato caso-crossover | -643 pazienti con diagnosi di SM definita o probabile | RR di MS recidiva entro 2 mesi dalla vaccinazione antinfluenzale: 1,08 (IC 95%, 0,37-3,10) | [ 63 ] | |
| Studi inclusi nel peso delle prove epidemiologiche per il vaccino influenzale e il GBS | ||||
| Vaccino influenzale | Studio controllato | -12 vaccinati | RR di insorgenza di GBS entro 8 settimane dalla vaccinazione antinfluenzale: 1,4 (IC 95%, 0,7-2,1) | [ 64 ] |
| -393 non vaccinato | ||||
| Studio controllato | Stagione 1979-1980: | RR di insorgenza di GBS entro 8 settimane dalla vaccinazione durante la stagione 1979-1980: 0,6 (IC 95%, 0,45-1,32). RR di insorgenza di GBS entro 8 settimane dalla vaccinazione durante la stagione 1980-1981: 1,4 (95% CI, 0,80-1,76) | [ 65 ] | |
| -7 vaccinati | ||||
| -412 non vaccinato | ||||
| Stagione 1980-1981: | ||||
| -12 vaccinati | ||||
| -347 non vaccinato | ||||
| Vaccino antinfluenzale | Studio auto-controllato | -Tre casi di GBS in periodo di rischio (42 giorni dopo il vaccino) | RR aggiustato di insorgenza di GBS entro 42 giorni dalla vaccinazione antinfluenzale: 0,99 (IC 95%, 0,32-3,12;p = 0,99) | [ 66 ] |
| -225 casi GBS nel periodo di controllo | ||||
| Studio auto-controllato | -51 casi di GBS in periodo di rischio (2-7 settimane dopo il vaccino) | RR di ospedalizzazione per insorgenza di GBS durante le 2-7 settimane successive alla vaccinazione antinfluenzale: 1,45 (IC 95%, 1,05-1,99) | [ 67 ] | |
| -141 casi di GBS nel periodo di controllo (26-43 settimane dopo il vaccino) | ||||
| Studio retrospettivo | 2005-2006: 12 eventi in periodo di rischio; 14.4 eventi nel periodo di controllo. 2006-2007: 17 eventi in periodo di rischio; 15,1 eventi nel periodo di controllo 2007-2008: 23 eventi nel periodo di rischio; 16,7 eventi nel periodo di controllo | RR di insorgenza di GBS (tutte le età) 1-42 giorni dopo la vaccinazione antinfluenzale durante la stagione 2005-2006: 0,83 RR di esordio GBS (tutte le età) 1-42 giorni dopo la vaccinazione antinfluenzale durante la stagione 2006-2007: 1,13 RR di insorgenza di GBS (tutte le età) 1-42 giorni dopo la vaccinazione antinfluenzale durante la stagione 2007-2008: 1,37 | [ 68 ] | |
Vaccino contro l'HBV e sclerosi multipla
La sclerosi multipla (SM), nota anche come "malattia infiammatoria demielinizzante cronica", è una malattia autoimmune del sistema nervoso centrale (SNC) con distruzione della mielina nel SNC o guaina di rivestimento delle fibre nervose. Si suppone che il meccanismo patogenetico della SM sia una risposta immunitaria iperattiva o disfunzionale all'auto-antigene. Le cellule T attivate inducono una cascata infiammatoria e un attacco cellulo-mediato della mielina del SNC [ 69 ]. La potenziale associazione tra la vaccinazione del virus dell'epatite B (HBV) e lo sviluppo della SM è stata registrata per la prima volta all'ospedale Paris (1995-1997) in 35 pazienti che hanno evidenziato eventi demielinizzanti primari, inclusi i cambiamenti infiammatori nel livello delle proteine del CSF e le lesioni nel bianco cerebrale importa su immagini RM pesate in T2, entro 8 settimane dall'iniezione di vaccino ricombinante HBV [ 70, 71 ], essendo i pazienti donne con un'età media di circa 30 anni. Erano ad alto rischio di SM, perché tutti avevano anche una rappresentazione eccessiva dell'antigene HLA-DR2 e una storia familiare positiva della malattia. Circa 200 casi di disordini demielinizzanti del SNC entro 2 mesi dopo la vaccinazione contro l'HBV sono stati segnalati al sistema di farmacovigilanza francese [ 72 ] e 2 anni dopo, il governo francese ha sospeso l'immunizzazione sistematica dei preadolescenti nelle scuole [ 73]. Tuttavia, questi studi sono stati criticati per limiti metodologici, inclusi i metodi usati per l'accertamento del caso e la selezione del controllo, la validazione dello stato vaccinale e il potere statistico limitato, poiché i risultati di due studi su larga scala non hanno mostrato un'associazione significativa tra la vaccinazione HBV e la Presenza di sclerosi multipla [ 74 , 75], ma sono state formulate anche opinioni diverse. Ad esempio, uno studio non pubblicato ha dimostrato con il metodo "cattura-ricattura" che il numero reale di casi di SM legati al vaccino HBV era 2-2,5 superiore al numero ufficialmente registrato nella farmacologia francese. Hernan e colleghi hanno eseguito uno studio caso-controllo su 163 casi di SM e 1604 controlli abbinati, nel Regno Unito all'interno del database di ricerca generale, e hanno rilevato un aumento degli odds ratio (OR) per la SM (OR 3.1; CI 1.5-6.3) all'interno del 3 anni dopo l'immunizzazione con HBV [ 76]. Un altro studio epidemiologico caso-controllo è stato condotto per valutare eventi avversi seri post-vaccinazione registrati negli Stati Uniti attraverso un sistema di segnalazione spontaneo nel database VAERS. Gli adulti che hanno ricevuto l'immunizzazione contro l'HBV hanno avuto un aumento significativo di OR per la SM (OR 5.2; CI 1.9-20) rispetto a un gruppo di vaccini contenenti tetano non esposto per età, sesso e vaccino [ 77 ]. Allo stesso modo, uno studio francese sulla demielinizzazione nell'infanzia [ 78 ] ha mostrato che la somministrazione del vaccino Engérix B® era associata a un aumento della tendenza della SM confermata dopo 3 anni (OR 2.77; CI 1.23-6.24). Terney e colleghi hanno descritto un caso clinico di una paziente (16 anni) con sintomi neurologici entro 10 settimane dall'immunizzazione dell'HBV[ 79 ]. Le analisi di laboratorio e la risonanza magnetica cerebrale hanno confermato encefalomielite acuta disseminata, collagenosi, sarcoidosi e un primo attacco di SM [ 80 ]. Il paziente è stato trattato con una terapia immunoglobulinica per 10 volte (1 g / kg / die) e ha mostrato un netto miglioramento. Questo rapporto indica un legame temporale tra l'episodio dell'encefalomielite e la vaccinazione contro l'HBV. Il meccanismo di questo collegamento non è chiaro, ma Faure et al. ipotizzare che sia dovuto al mimetismo molecolare: la proteina HBV-polimerasi (HBV-pol), che potrebbe essere un contaminante nei vaccini ricombinanti o derivati dal plasma, potrebbe essere co-purificata con HBsAg durante il processo di produzione e potrebbe agire come autoantigene, innescando una malattia demielinizzante autoimmune, come la SM [ 81 ].
La controversia tra gli studi citati suggerisce la necessità di ulteriori indagini sulla relazione tra la vaccinazione contro l'HBV e lo sviluppo della SM.
Vaccino contro l'HBV e lupus eritematoso sistemico
Il lupus eritematoso sistemico (SLE) è una malattia infiammatoria autoimmune cronica multisistemica con eziologia multifattoriale, inclusa suscettibilità genetica, differenze di genere e alterazioni del sistema immunitario innescate da fattori ambientali, come la radiazione ultravioletta (luce solare) e agenti infettivi, principalmente virus [ 82 , 83 ]. La mortalità e la morbilità del LES sono migliorate significativamente nell'ultimo decennio e le infezioni virali sono state dichiarate all'inizio o nel peggioramento dei sintomi di LES (20-55%) [ 84 ].
Diversi studi hanno riportato la relazione tra il vaccino SLE e HBV, con associazione temporale / causale statisticamente significativa, probabilmente a causa della bassa prevalenza dell'autoimmunità post-vaccinazione, bassa velocità di segnalazione degli eventi avversi post-vaccinazione e vari periodi di latenza tra la vaccinazione e l'insorgenza di malattia, così come la presentazione atipica dell'autoimmunità dopo il vaccino [ 85 , 86 ].
Ad esempio, uno studio caso-controllo di 265 pazienti con SLE e 355 soggetti di controllo ha mostrato che il 95% delle persone con SLE riportava una storia di allergia ai farmaci, in particolare agli antibiotici. C'era poca associazione con la storia della mononucleosi, un marker di infezione tardiva con virus Epstein-Barr, dispositivi medici impiantati o vaccinazione contro l'epatite B [ 87 ].
Il primo caso di LES identificato dopo il vaccino HBV è registrato da Guiserix et al. [ 88 ]. Una donna di 26 anni si è presentata con la febbre; eruzione cutanea del viso, delle braccia e delle gambe; e brividi dopo una settimana di una prima dose di vaccino HBV ricombinante (GenHevac-B). La biopsia cutanea e i test immunologici (anticorpi antinucleari, componente del complemento C3 e livello C4), effettuati 3 mesi dopo, hanno confermato la diagnosi di LES. Gli autori supponevano che la proteina antigenica di superficie Hb potesse svolgere un ruolo patogenetico significativo e che il paziente con quadro clinico SLE dovesse interrompere il protocollo di immunizzazione, ripetendo il test degli anticorpi antinucleari 3 mesi dopo [ 89].
Agmon-Levin e colleghi hanno analizzato retrospettivamente le cartelle cliniche di 10 pazienti affetti da LES che hanno sviluppato la malattia dopo la vaccinazione contro l'HBV (20% dopo la prima dose, 20% dopo la seconda dose e 60% dopo la terza dose) [ 90 ]. Il periodo medio di latenza dalla prima immunizzazione con HBV e l'insorgenza di sintomi autoimmuni era di 56,3 giorni. Le tipiche manifestazioni SLE includevano articolazioni (100%), pelle (80%), muscoli (60%) e fotosensibilità (30%). Sette pazienti (70%) hanno seguito il protocollo di vaccinazione anche se è stato notato un possibile evento avverso autoimmune con un periodo di follow-up tra 1 e 17 anni. I risultati clinici hanno mostrato ANA positivi e altri autoanticorpi nel 90% dei pazienti, bassi livelli di complemento in tre dei quattro pazienti esaminati; e livelli elevati di citochine [recettore dell'interleuchina-2 (IL-2), interferone-alfa (INFa) e fattore di necrosi tumorale (TNF)] in un paziente. Di conseguenza, con questo studio, altri hanno riportato un periodo di latenza di diversi giorni a 2 anni tra l'immunizzazione e l'insorgenza di SLE, dal momento che il vaccino post-HBV condizioni autoimmuni possono essere condizioni transitorie (ad esempio, vasculite, artrite, eritema nodoso) e insorgenza o recidiva di una malattia definita (ad esempio, artrite reumatoide, sclerosi multipla, SLE) [ 91 ].
L'interazione causa-effetto tra il vaccino HBV e SLE non è chiara, sebbene l'autoimmunità vaccinale post-HBV possa essere correlata ad un aumento del numero di immunocomplessi e al mimetismo molecolare tra alcuni componenti del vaccino (ad es. alluminio, lievito, thimerosal) e auto-antigeni [ 92 ]. Questa teoria è supportata dallo studio di Kowal et al. [ 93 ] che ha dimostrato cross-reattività, a livello molecolare, tra gli anticorpi anti-batterici anti-pneumococco e la generazione di anticorpi anti-DNA, nei pazienti con LES.
Gli individui che sviluppano una malattia cronica post-vaccinazione sono rari rispetto al numero di vaccini somministrati. Tuttavia, medici e pazienti dovrebbero essere incoraggiati a chiedere di routine sulla vaccinazione precedente e riportare tale possibile associazione, poiché nella maggior parte dei paesi la segnalazione di eventi avversi del vaccino si basa su una notifica volontaria piuttosto che obbligatoria.
Studi epidemiologici, riportati in tabella Tabella 3,3 , hanno ipotizzato che il vaccino potrebbe essere l'evento precipitante ma questi studi non hanno fornito prove che collegano queste malattie autoimmuni al vaccino HBV.
Tabella 3:
Riassunto degli studi epidemiologici sulla relazione tra vaccino HBV e malattie autoimmuni
| Digitare il vaccino | Studio di progettazione | pazienti | Risultati: dimensione dell'effetto primario stimata (95% CI o valore p) | arbitro |
|---|---|---|---|---|
| Studi inclusi nel peso dell'evidenza epidemiologica del vaccino HBV e della neurite ottica | ||||
| Vaccino HBV | Studio di controllo dei casi | -108 pazienti con neurite ottica, | O per neurite ottica insorgenza in qualsiasi momento dopo la vaccinazione contro l'epatite B: 1,2 (IC 95%, 0,5-3,1) | [ 60 ] |
| -228 controlli | ||||
| Studio di controllo dei casi | -1.131 pazienti con neurite ottica, | O per insorgenza di neurite ottica entro 18 settimane dalla vaccinazione contro l'epatite B: 1,02 (IC 95%, 0,68-1,54) | [ 61 ] | |
| -3,393 controlli | ||||
| Studi inclusi nel peso dell'evidenza epidemiologica dell'HBV Vaccino e dell'inizio della SM negli adulti | ||||
| Vaccino HBV | Studio di controllo dei casi | -190 pazienti con SM | RR aggiustato per l'età della SM insorgenza in qualsiasi momento dopo la vaccinazione contro l'epatite B rispetto ai controlli sani: 0,9 (IC 95%, 0,5-1,6) | [ 19 ] |
| -534 controlli sani, | RR RR-aggiustato per l'età della SM entro 2 anni dalla vaccinazione contro l'epatite B rispetto ai controlli sani: 0,7 (IC 95%, 0,3-1,7) | |||
| -111 controlli del cancro al seno | RR aggiustato per l'età della SM insorgenza in qualsiasi momento dopo la vaccinazione contro l'epatite B rispetto ai controlli del cancro della mammella: 1,2 (IC 95%, 0,5-2,9) | |||
| RR RR-aggiustato per età della SM entro 2 anni dalla vaccinazione contro l'epatite B rispetto ai controlli del cancro della mammella: 1.0 (IC 95%, 0.3-4.2) | ||||
| Vaccino HBV | Studio di controllo dei casi | -332 pazienti affetti da SM, | O per l'insorgenza della SM in qualsiasi momento dopo la vaccinazione contro l'epatite B: 0,8 (IC 95%, 0,5-1,4 | [ 60 ] |
| -722 controlli | ||||
| Caso di controllo | -163 pazienti affetti da SM, | O per l'insorgenza della SM entro 3 anni dalla vaccinazione contro l'epatite B: 3.1 (IC 95%, 1.5-6.3) | [ 76 ] | |
| -1,604 controlli | ||||
| Studi inclusi nel peso dell'evidenza epidemiologica del vaccino HBV e del primo evento demielinizzante negli adulti | ||||
| Vaccino HBV | Studio controllato | -440 pazienti con malattia demielinizzante; | O per l'insorgenza della malattia demielinizzante in qualsiasi momento dopo la vaccinazione contro l'epatite B: 0,9 (IC 95%, 0,6-1,5) | [ 60 ] |
| -950 controlli | ||||
| Studio controllato | -1.131 pazienti con neurite ottica; | O per insorgenza di neurite ottica entro 18 settimane dalla vaccinazione contro l'epatite B: 1,02 (IC 95%, 0,68-1,54) | [ 61 ] | |
| -3,393 controlli | ||||
| Studio auto-controllato | -234 pazienti con un primo evento demielinizzante del SNC | RR del primo evento demielinizzante 0-60 giorni dopo la vaccinazione contro l'epatite B: 1,68 (IC 95%, 0,76-3,68). RR del primo evento demielinizzante 61-365 giorni dopo la vaccinazione contro l'epatite B: 1,33 (IC 95%, 0,65-2,69). RR del primo evento demielinizzante a tempo indeterminato (massimo di 2,29 anni) dopo la vaccinazione contro l'epatite B: 1,35 (IC 95%, 0,61-3,01) | [ 94 ] | |
Vaccino MMR e trombocitopenia idiopatica
Un altro effetto negativo confermato autoimmune associata con la vaccinazione è l'induzione di trombocitopenia idiopatica (ITP), noto anche come trombocitopenia immune, seguendo il vaccino morbillo-parotite rosolia (MMR), in particolare entro 6 settimane dalla vaccinazione [ 95 - 97 ]. L'ITP è una condizione autoimmune, caratterizzata clinicamente da una bassa conta piastrinica (meno di 100.000 piastrine per microlitro) a causa dell'aumento della distruzione e della ridotta produzione piastrinica e dalla presenza di autoanticorpi (IgG) diretti contro gli antigeni della membrana piastrinica (glicoproteine IIb-IIIa) [ 98 ]. Le principali manifestazioni cliniche comprendono vari gradi di porpora cutanea e / o mucosa; emorragie potenzialmente letali si verificano in meno del 5% dei pazienti adulti [99 ]. Il rischio di ITP dopo il vaccino MMR è visto più alto nei bambini, di età compresa tra 12 e 19 mesi, che è l'età stimata in cui i bambini normalmente riceverebbero il vaccino MMR.
Lo sviluppo di ITP dopo la somministrazione di un vaccino vivo attenuato contro il morbillo fu descritto per la prima volta da Oski e Naiman nel 1966 [ 100 ]. Da allora, i dati epidemiologici hanno chiaramente dimostrato tassi di incidenza più elevati di ITP dopo vaccino MMR, somministrati da soli o in combinazione [ 101 , 102 ]; e nel 1993, il Vaccine Safety Committee dell'Istituto di Medicina dichiarò la potenziale relazione tra il vaccino MMR e la ITP [ 103 ].
Miller e colleghi hanno identificato 35 casi (età compresa tra 12 e 23 mesi) di ITP dopo vaccinazione MMR e hanno stimato che il rischio attribuibile di ITP entro 6 settimane dalla vaccinazione MMR è 1 su 32.300 vaccinazioni [ 8 ]. Questi risultati sono stati confermati nell'ulteriore studio caso-controllo: 23 bambini (di età compresa tra 13 e 24 mesi) hanno sviluppato ITP dopo aver ricevuto la loro prima inoculazione della dose di MMR, manifestando sintomi tra il 7 ° e il 28 ° giorno dopo la vaccinazione.
Francia e colleghi hanno valutato il rischio di ITP dopo l'immunizzazione con MMR in una grande popolazione (1.036.689 bambini, di età compresa tra 12 mesi e 18 anni) [ 104 ]. Utilizzando database elettronici, hanno identificato 1673 individui come potenziali casi (basso numero di piastrine ≤50.000 / μl). Di questi, hanno escluso 532 che avevano una causa nota di trombocitopenia (ad es. Anemia aplastica, leucemia) e 546 che avevano 30 giorni di età al momento della diagnosi. Questi dati erano simili in grandezza ai risultati di Miller et al. (IRR: 3.27) e Black et al. (odds ratio: 6.10) [ 105 , 106]. Inoltre, gli autori hanno trovato un'associazione significativa (IRR: 7.1) su bambini di età compresa tra 12 e 15 mesi. L'ipotesi che la ITP correlata alla MMR possa essere dovuta a uno specifico meccanismo immunologico è supportata dai recenti risultati di Okazaki [ 109 ] che hanno rilevato anticorpi IgG anti-morbillo e anti-rosolia in piastrine isolate da un caso (15 mesi) che sviluppato ITP entro 4 settimane dal vaccino MMR sequenziale. Gli anticorpi sono stati trovati il giorno 154 di malattia quando la conta piastrinica era molto bassa ma non era più rilevabile il giorno 298 (alla fine del periodo di trombocitopenia) o il giorno 373, quando la malattia era guarita [ 107]. Alcuni casi di ITP che possono essere negativi per gli anticorpi antipiastrinici possono essere dovuti ad altri meccanismi: qui si sospetta la distruzione immuno-mediata delle cellule T complementari o la riduzione della formazione delle piastrine e con la presentazione di antigeni glicoproteici agli APC viene stimolata la generazione di autoanticorpi, e ITP può verificarsi [ 108 , 109 ].
In ogni caso, la ITP scompare in alcuni giorni o settimane nella maggior parte dei casi: oltre il 90% dei bambini sono completamente guariti entro 6 mesi dalla diagnosi e meno del 10% sviluppa malattie croniche [ 110 ].
In conclusione, sebbene il vaccino MMR sia associato a un aumentato rischio di ITP, il rischio è inferiore rispetto ai virus selvaggi e il quadro clinico è meno grave. I bambini con ITP cronica richiedono un approccio più cauto: ad esempio, il comitato britannico per gli standard in ematologia consiglia di misurare i titoli del morbillo prima della somministrazione di richiamo al fine di decidere se è indicata un'ulteriore dose. Se un bambino non è stato precedentemente immunizzato, il rapporto rischio-beneficio di MMR deve essere valutato rispetto al rischio di morbillo nella comunità al momento [ 111 ].
Vaccino MMR e artrite reumatoide
L'artrite reumatoide (RA) è una malattia autoimmune cronica di eziologia sconosciuta, caratterizzata da poliartrite infiammatoria che colpisce l'1% della popolazione adulta nel mondo [ 112 , 113 ]. L'AR è causata da una combinazione di suscettibilità genetica e fattori ambientali, inclusi non solo l'aumento dei livelli anticorpali del virus del morbillo, ma anche il ceppo vaccinale [ 114 ]. Alcuni casi clinici descrivono l'artrite come una complicanza comune del virus della rosolia negli adulti, ma si verifica meno spesso nei bambini; che in diversi casi rappresenta la prima manifestazione clinica di RA [ 115 ].
Nussinovitich e collaboratori (1995) descrissero il primo caso di monoartrosi acuta con versamento in un bambino (19 mesi) entro 8 giorni dopo il parotite e il vaccino contro il morbillo, molto probabilmente a causa della componente parotite [ 116 ]. I risultati di laboratorio hanno confermato quanto segue (1) Gli anticorpi contro la parotite (IgG) misurati 1 mese dopo i test di fissazione del complemento erano 1/64; (2) Gli anticorpi del morbillo erano 1/16 (il titolo normalmente previsto dopo la vaccinazione era> 1/8). Il paziente è stato trattato con cefuroxime per via endovenosa per 5 giorni, seguito da cefalossina per via orale per altri 21 giorni; e i suoi sintomi articolari si placarono entro 24 ore.
Un altro studio ha valutato l'incidenza delle manifestazioni articolari entro 6 settimanedall'immunizzazione MMR [ 117 ]: comprendeva 2658 bambini vaccinati e 2359 non vaccinati, confermando un aumento del rischio di sintomi articolari (artralgia o artrite) nei bambini immunizzati.
Symmons et al. [ 23 ] suggeriscono tre possibili spiegazioni alla potenziale associazione tra immunizzazione e sviluppo di artrite: (1) è dovuta alla casualità di due fenomeni comuni: immunizzazione e artrite; (2) il vaccino attiva una forma specifica di artrite che è distinta dalla RA (artrite post-immunizzazione) e che di solito è auto-limitata; e (3) il vaccino è uno dei fattori che possono innescare lo sviluppo di RA (così come le infezioni). Alcuni studi sono stati identificati, nella letteratura, da specifico comitato scientifico per valutare il rischio di malattie autoimmuni dopo la somministrazione di vaccino MMR (Tabella (Table44 ).
Tabella 4:
Riassunto degli studi epidemiologici sulla relazione tra vaccino MMR e malattie autoimmuni
| Digitare il vaccino | Studio di progettazione | pazienti | Risultati: dimensione dell'effetto primario stimata (95% CI o valore p) | arbitro |
|---|---|---|---|---|
| Studi inclusi nel peso dell'evidenza epidemiologica del vaccino MMR e dell'artralgia transitoria in donne e bambini | ||||
| Vaccino MMR | Studio retrospettivo | - 485 donne vaccinate; | Vaccinato: 4 casi di artralgia (0,8%). Non vaccinati: 3 casi di artralgia (0,6%). Le differenze non erano statisticamente significative | [ 118 ] |
| - 493 donne non vaccinate | ||||
| Studio controllato in doppio cieco, randomizzato | -268 vaccinati, | Artralgia acuta o artrite entro 12 mesi dalla vaccinazione contro la rosolia: 1,73 (IC 95%, 1,17-2,57) | [ 119 ] | |
| -275 ricevuto placebo | ||||
| Studio retrospettivo | -971 sieronegative, donne vaccinate, | Vaccinato: 4 pazienti diagnosticati come casi acuti di artralgia e 1 come indeterminato, sieropositivo, non vaccinato. Controlli: un evento acuto | [ 120 ] | |
| -2.421 controlli sieropositivi, non vaccinati, di età corrispondente; | ||||
| -924 controlli sieronegativi, non vaccinati e ineguagliati | ||||
| Studio controllato in doppio cieco, randomizzato | Presenza del virus Repubblica Dominicana-2 (DR2): | Artralgia acuta o artrite entro 12 mesi dalla vaccinazione contro la rosolia nelle donne che esprimono DR2: 4,8 (IC 95%, 1,2-18,8) | [ 121 ] | |
| 41 vaccinati; | ||||
| 38 ricevuto placebo | ||||
| Vaccino MMR | Studio crossover controllato in doppio cieco | 581 coppie di gemelli | Tasso di differenza massima di artropatia tra vaccino MMR e gruppi placebo a 7-9 giorni dopo la vaccinazione: 0,8% (IC 95%, 0,2-1,3%) | [ 122 ] |
| Studio crossover controllato in doppio cieco | 581 twin pairs, separated into two age groups: 14–18 months and 6 years of age | Adjusted OR of arthralgia in the 14–18 month age group within 21 days of MMR vaccination: 3.66 (95% CI, 1.74–7.70) | [123] | |
| Double-blind, randomized control trial | 2,216 vaccinated with MMR II, 3,521 unvaccinated | MMR II group: 8 joint reactions (primarily transient arthralgia) within 30 days of vaccination | [124] | |
| Case-control | 125 patients with psoriatic arthritis; 163 patients with psoriasis | OR for psoriatic arthritis after rubella vaccination: 12.4 (95% CI, 1.20–122.14) | [125] | |
| Studies included in the weight of epidemiologic evidence for MMR Vaccine and Type 1 Diabetes | ||||
| MMR vaccine | Case-control | -393 children with type 1 diabetes; | OR for type 1 diabetes diagnosis; any time after MMR vaccination: 0.95 (95% CI, 0.71–1.28) OR for type 1 diabetes diagnosis any time after measles vaccination: 0.74 (95% CI, 0.55–1.00) OR for type 1 diabetes diagnosis any time after mumps vaccination: 1.75 (95% CI, 0.54–5.70). OR for type 1 diabetes diagnosis any time after rubella vaccination: 1.24 (95% CI,0.41–3.73) | [126] |
| -786 controls matched on age, sex, and county | ||||
| Case-control | -136 children with type 1 diabetes; | OR for type 1 diabetes diagnosis any time after MMR vaccination: 0.382 (95% CI, 0.201–0.798) OR for type 1 diabetes diagnosis any time after measles vaccination: 0.777 (95% CI, 0.403–1.498) | [127] | |
| -272 controls matched on age and registration with the same family pediatrician | ||||
| Retrospective cohort | 739,694 children | Rapporto di frequenza per la diagnosi di diabete di tipo 1 in qualsiasi momento dopo una dose di vaccino MMR rispetto al non esposto: 1,14 (IC 95%, 0,90-1,45) | [ 56 ] | |
Vaccino HPV e insufficienza ovarica primaria
I vaccini HPV (come Gardasil® e Cervarix®) sono stati introdotti per combattere il cancro cervicale; tuttavia, sono stati segnalati diversi casi di insorgenza o esacerbazioni di malattie autoimmuni in seguito alla vaccinazione [ 128 ]. Nel 2013, Colafrancesco ha esaminato tre donne (due di loro sono sorelle, portando così l'importanza del legame genetico) che ha sviluppato il fallimento ovarico primario entro 2 anni dal vaccino HPV [ 129]. Tutti i pazienti hanno sviluppato amenorrea secondaria, basso estradiolo e ormone follicolo-stimolante (FSH) e ormone luteinizzante (LH) dopo la vaccinazione HPV e livelli elevati di anti-anticorpi (ad esempio anticorpi anti-tiroide e anticorpi anti-ovarico). Gli autori hanno suggerito che l'uso di adiuvanti nel vaccino HPV potrebbe essere un fattore di rischio per l'elicitazione di una reazione autoimmune alla vaccinazione: i frammenti di DNA rilevati in 16 diversi vaccini Gardasil® sembravano legati all'alluminio usato nella formulazione del vaccino.
Vaccino HPV e SLE
Nel 2013 Gatto e collaboratori hanno esaminato casi di LES nelle donne che hanno seguito la vaccinazione contro l'HPV [ 130 ]. L'insorgenza di SLE si è verificata durante le successive dosi del programma di vaccinazione HPV e tutte le donne hanno avuto una storia familiare di malattia autoimmune. I principali pazienti remissivi con terapia immunosoppressiva hanno avuto effetti avversi lievi sul vaccino immediatamente dopo la prima dose del vaccino HPV e successivamente hanno sviluppato sintomi di LES più pesanti entro due mesi dopo la successiva somministrazione di vaccino. In conclusione, gli autori hanno ipotizzato un potenziale nesso causale tra vaccinazione HPV e insorgenza o recidiva di SLE [ 130]. Pertanto, sebbene per la maggior parte dei pazienti i benefici dell'immunizzazione superino i suoi rischi, i clinici devono essere consapevoli delle probabilità di insorgenza o esacerbazione di una malattia autoimmune in seguito alla vaccinazione contro l'HPV. Una meticolosa valutazione del rapporto rischio-beneficio pre-vaccinazione, un attento follow-up durante e dopo ogni incremento della vaccinazione, così come la valutazione della terapia concomitante con agenti immunodegolanti come l'idrossiclorochina (HCQ), sembra ragionevole per i pazienti con una malattia autoimmune. Nel 2013, Macartney e colleghi hanno esaminato la letteratura sugli effetti avversi correlati al vaccino HPV e hanno riportato reazioni lievi come gonfiore locale del sito di iniezione con dolore locale o generalizzato [ 131]. Le segnalazioni soggettive sono la fonte primaria di eventi avversi del vaccino, ma è necessario un approccio sistematico per tracciare la morbilità della vaccinazione. Inoltre, il breve follow-up stabilito istituzionalmente dalle autorità sanitarie fallisce le reazioni avverse a lungo termine lievi e gravi e un ampio gruppo vaccinato geneticamente diverso definirebbe meglio il problema. Pertanto, la sorveglianza a lungo termine dei vaccini tra i gruppi di popolazioni interetniche definirebbe più accuratamente la loro sicurezza.
Vaccino HPV e sindrome di ASIA
Recentemente, diversi rapporti hanno suggerito di raggruppare diverse condizioni autoimmuni che sono innescate da stimoli esterni (es. Esposizione al vaccino) come una singola sindrome chiamata sindrome autoimmune indotta da adiuvanti (ASIA) [ 132]. Questa sindrome è caratterizzata dalla comparsa di mialgia, miosite, debolezza muscolare, artralgia, artrite, stanchezza cronica, disturbi del sonno, deterioramento cognitivo e perdita di memoria. Questo termine è stato introdotto da Yehuda Shoenfeld, che ha evidenziato il ruolo patogeno degli adiuvanti nell'induzione delle sindromi autoimmuni: questi composti mimano molecole conservate evolutivamente (ad es., Pareti cellulari batteriche, LPS, CpG-DNA non metilato) e si legano ai recettori toll-like ( TLR). Attivano le cellule dendritiche (DC), i linfociti e i macrofagi, aumentando successivamente il rilascio di chemochine e citochine da T-helper e mastociti [ 133- 137]. Gli adiuvanti aggiunti nei vaccini possono indurre un'attivazione non specifica del sistema immunitario con una successiva espansione dei linfociti autoreattivi (nel nostro caso specifici della mielina) che possono essere ulteriormente accelerati da cellule / circuiti regolatori difettosi, in individui geneticamente suscettibili. Infatti, i principali soggetti al rischio di sindrome ASIA sono i seguenti: (1) pazienti con precedenti fenomeni autoimmuni post-vaccinazione, (2) pazienti con anamnesi di autoimmunità, (3) pazienti con anamnesi di reazioni allergiche e individui che sono inclini a sviluppare autoimmunità (con una storia familiare di malattie autoimmuni, presenza di autoanticorpi, portatori di alcuni profili genetici, ecc.) [ 138 ].
Nel 2016, abbiamo retrospettivamente descritto una serie di casi di cui 18 ragazze (di età compresa tra 12 e 24 anni) per la valutazione di "neuropatia con disfunzione autonomica" immediatamente dopo il vaccino HPV [Gardasil® (9 ragazze) e Cervarix® (9 ragazze)] [ 139 ]. Tutte le ragazze si sono lamentate dei sintomi somatoformi di lunga durata e invalidanti della sindrome ASIA recentemente descritta (tra cui astenia, cefalea, disfunzioni cognitive, mialgia, tachicardia sinusale ed eruzioni cutanee) che si sono sviluppati da 1 a 5 giorni ( n = 11), 5- 15 giorni ( n = 5) e 15-20 giorni ( n = 2) dopo l'ultima dose di vaccinazione. La formula del vaccino HPV contiene alluminio (225 e 500 μg / dose ciascuna in Gardasil® e Cervarix®, rispettivamente) ma anche una concentrazione elevata di polisorbato 80 (50 mcg) che potrebbe anche indurre una maggiore permeabilità meningea che porta a un ingresso facilitato di molte sostanze a il CNS. Sulla base di queste osservazioni, si potrebbe ipotizzare che il vaccino HPV potrebbe indurre qualche attivazione anormale delle cellule immunitarie competenti nel SNC, come la glia.
Tra i fattori di rischio per la sindrome di ASIA, è stata sospettata l'ipersensibilità del metallo nelle ragazze, principalmente individui geneticamente predisposti, esposti a vaccinazione. Abbiamo testato cinque metalli adiuvanti (alluminio, mercurio, nickel, metil-mercurio, thimerosal) nelle nostre serie di casi tramite test del sangue in vitro e test di trasformazione dei linfociti (MELISA®). Tuttavia, lo studio era frustrante, essendo le sette ragazze negative per ciascuno dei cinque metalli testati, mostrando un'ipersensibilità al metallo solo in nove pazienti: tossicità per l'alluminio (due ragazze), reattività al nichel (sette ragazze), seguito dal mercurio ( quattro ragazze) [ 140 ].
Il controllo dei casi e gli studi epidemiologici e un'analisi genetica dettagliata delle ragazze colpite e della loro famiglia potrebbero definire meglio il legame tra la vaccinazione e il danno al SNC.
Vaccino HPV e mielite trasversa
La mielite trasversa (TM) è il paradigma della mielopatia infiammatoria, in cui un processo immuno-mediato provoca lesioni neurali al midollo spinale, con conseguente vari gradi di debolezza, alterazioni sensoriali e disfunzione autonomica. La TM può esistere come parte di una malattia multifocale del sistema nervoso centrale (ad esempio, sclerosi multipla), malattia multisistemica (es. SLE) o come entità idiopatica isolata [ 141 ]. Una recente review (2014) riassume nove casi pubblicati di demielinizzazione del SNC, tra cui non solo la mielite, ma anche la neurite ottica e l'encefalite, a seguito della vaccinazione contro l'HPV [ 142]. Ci sono precedenti segnalazioni di sindromi infiammatorie del SNC a seguito di vaccinazione HPV che descrive un lasso di tempo da 10 giorni a 5 mesi dalla vaccinazione all'esordio dei sintomi, con un intervallo di almeno 21 giorni nei casi di sviluppo di mielite. Per esempio, una ragazza immunocompetent di 14 anni ha notato che la sua mano sinistra si sentiva debole e insensibile, dopo 3 giornidi una prima dose di vaccino HPV (Gardasil®) e questi sintomi si diffondono al resto del braccio e nella regione toracica omosessuale, nell'addome e nella gamba. Durante una visita medica, la ragazza aveva una sensazione bilaterale diminuita al tocco leggero, dolore e vibrazione al di sotto del livello C5; debolezza muscolare del braccio e della gamba sinistra; e iperriflessia bilaterale con clone non insetto e risposta plantare estensore sinistro. L'esame neurologico era altrimenti normale. La relazione tra la vaccinazione HPV e la successiva infiammazione del SNC non è chiara. Nella genesi dei disordini infiammatori del sistema nervoso centrale dopo la vaccinazione post-HPV, sia la mimica molecolare tra l'antigene vaccino e le proteine della mielina che i materiali tossici nei componenti del vaccino possono rappresentare potenziali fattori causali [ 143]. Per quanto riguarda l'eziologia, il paziente era immunocompetente e non c'erano segni sistemici di infezione. L'assenza di cellule nell'analisi del CSF e la presenza di bande oligoclonali con un rapporto di immunoglobuline M non specifico ha suggerito uno sfondo di una condizione infiammatoria del SNC; tuttavia, il meccanismo della malattia, sia essa indotta dal virus o immuno-mediata, rimane da determinare.
Base genetica per le malattie autoimmuni in seguito alla vaccinazione
Diversi studi hanno identificato varianti genetiche della famiglia di geni dell'antigene leucocitario umano (HLA), significativamente associati all'attivazione autoimmune indotta da vaccino; alcune di queste varianti HLA includono HLA DRB1, HLA DRB2, HLA DR4, HLA e DRQ8 che sono coinvolte nei processi autoimmuni, come il rilevamento e la rimozione degli antigeni durante l'infezione [ 144 - 146 ].
Uno studio significativo, condotto nel 2008, ha trovato correlazioni statistiche tra sei varianti genetiche [tre varianti di interleuchina 4 (IL4), due varianti del fattore regolatore dell'interferone (IRF1) e una variante di metilenetetraidrofolato reduttasi (MTHFR), l'allele C677T] e vaccino per eventi avversi dopo vaccino contro il vaiolo [ 147 ].
IL4 è una citochina antinfiammatoria coinvolta nella risposta immunitaria infiammatoria cellulo-mediata, inclusa l'inibizione della migrazione di monociti e cellule dendritiche al tessuto infiammato e la promozione di vie effettrici di Th2 [ 148 , 149 ]. La differenziazione delle cellule T CD4 + dal percorso Th1 li rende incapaci di attivare i macrofagi. In seguito a una sfida immunologica mediante vaccinazione, la differenziazione delle cellule T CD4 + nelle cellule Th1 e Th2 armate gioca un ruolo vitale nel determinare se la risposta immunitaria adattativa sarà dominata da effettori umorali o attivazione dei macrofagi [ 150]. Pertanto, i polimorfismi genetici correlati alla regolazione inappropriata dell'espressione di IL-4 e / o dell'attività della citochina IL-4 possono sovrastimolare le risposte infiammatorie, portando allo sviluppo di eventi avversi. La disregolazione di IL-4 può anche avere un ruolo negli eventi avversi conseguente alla clearance inappropriata delle cellule immunitarie effettrici apoptotiche dopo l'infezione, poiché questa funzione viene normalmente eseguita dai macrofagi.
IRF1 è un fattore di trascrizione coinvolto nel rilascio di interferone citotossico e nell'apoptosi cellulare; può spingere l'attività dei macrofagi oltre la soglia dello sviluppo di AE [ 151 ]. L'iperattività IRF1 può anche prolungare la vita delle cellule immunitarie che dovrebbero essere eliminate dopo l'infezione, prolungando il periodo di infiammazione e portando a eventi avversi.
La variante MTHFR 677 è stata associata a numerosi fenotipi, tra cui la funzionalità cardiovascolare, la salute dei trapianti, la tossicità dei farmaci immunosoppressori e l'infiammazione sistemica [ 152 , 153 ]. Elevati livelli plasmatici di omocisteina stimolano le risposte infiammatorie endoteliali, che potrebbero contribuire a eventi avversi. In alternativa, poiché la vaccinazione provoca 109 risposte immunitarie che implicano la rapida proliferazione di cellule, la richiesta di metaboliti di sintesi del DNA sarebbe elevata e le alterazioni nel livello o nell'attività dell'enzima MTHFR possono esercitare un'influenza significativa su questo processo.
I risultati di questo studio dimostrano l'utilità della convalida in studi genetici di fenotipi complessi. Come con qualsiasi associazione statistica, sono necessari studi di follow-up per identificare le particolari varianti di suscettibilità genetica ed esaminare le conseguenze funzionali dei polimorfismi nei geni associati a AE. Dal momento che gli autori hanno trovato più SNP associati a AE in regioni di IL-4 e IRF1, dovrebbero essere intrapresi studi focalizzati per caratterizzare la variabilità genetica in queste regioni candidate. Mentre l'associazione di eventi avversi con un polimorfismo non sinonimo nel gene 113 per MTHFR punta verso il significato funzionale di questo SNP, la resezione profonda dovrebbe determinare se questo è davvero il caso. Per tutti e tre i geni candidati, sono necessari studi funzionali per collegare i polimorfismi genetici agli eventi avversi dopo l'immunizzazione.
Discussione
La maggior parte degli studi sugli eventi avversi correlati al vaccino si riducono ad un'analisi di follow-up di 10-20 giorni, il reclutamento di eventi autoimmuni potenzialmente correlati. L'analisi della potenziale correlazione tra vaccino e eventi / malattie autoimmuni è sconcertante, essendo non specifica e senza una diagnosi chiara, senza escludere altre infezioni virali contemporanee, fattori ambientali o squilibri nutrizionali. Gli adiuvanti (ad esempio alluminio, thimerosal) nei vaccini erano correlati a livelli di autoanticorpi, quali anticorpi anticardiolipina sollevati dopo vaccinazione antinfluenzale in pazienti con lupus, anticorpi anti-Epstein-Barr dopo vaccino HPV [ 139 , 154 - 156]. Gli adiuvanti migliorano e prolungano la risposta immunitaria, promuovendo la protezione fisica contro il patogeno e facilitando la sua traslocazione ai linfonodi [ 157 ]. Lo sviluppo di un vaccino inattivato sarebbe una soluzione per gli individui immunosoppressi. Tuttavia, i vaccini uccisi possono avere svantaggi come rischio di inattivazione incompleta, cambiamento delle proprietà immunogeniche del virus e uso di dosi multiple [ 158 , 159 ]. La relazione tra vaccini e autoimmunità è bidirezionale. Da un lato, l'immunizzazione previene le malattie infettive, e quindi a sua volta impedisce lo sviluppo di una malattia autoimmune conclamata che in alcuni individui è scatenata da infezioni. Inoltre, Singh et al. [ 160] suggeriscono che l'immunizzazione con alcuni vaccini può stimolare il sistema immunitario a modulare o prevenire la generazione di cellule patogene mediante l'induzione di cellule regolatrici e quindi a prevenire l'autoimmunità. Gli eventi avversi post-vaccinazione suggeriscono fortemente che le vaccinazioni possono innescare l'autoimmunità in modo simile alle infezioni da prevenire. In questo modo, la vaccinazione dovrebbe essere considerata parte del mosaico di autoimmunità, in cui l'abrogazione di una malattia autoimmune (e nel caso della vaccinazione, la prevenzione di una malattia autoimmune) potrebbe causare contemporaneamente un'altra malattia autoimmune.
Durante il processo di vaccinazione, solo una strategia completa e multidisciplinare può aiutare a ridurre il rischio che una nuova induca reazioni autoimmuni: (1) la domanda se le manifestazioni cliniche di natura autoimmune siano note come associate alla malattia infettiva che sarà l'obiettivo del nuovo vaccino deve essere alzato. Se tali eventi sono stati segnalati, ad esempio, per le malattie da streptococco di gruppo A, occorre prestare attenzione per evitare di riprodurre il processo patogenetico naturale; questo processo potrebbe includere l'identificazione e l'esclusione di epitopi naturalmente patogeni; (2) potenziale mimetismo molecolare e immunologico tra antigeni vaccinali e componenti dell'ospite dovrebbe essere ampiamente analizzato attraverso una combinazione di bioinformatica e studi immunologici. Dovrebbero essere raccolte informazioni sulla capacità relativa di tali epitopi di legarsi alle molecole MHC, di essere processati da cellule presentanti l'antigene e di essere riconosciuti dalle cellule T autoreattive. Il mimetismo molecolare di per sé non è sufficiente per innescare la patologia autoimmune e potrebbero essere necessari anche altri fattori intrinseci alle infezioni, come il danno tissutale e una reazione infiammatoria di lunga durata. Ad esempio, un nuovo vaccino per la malattia di Lyme contiene un epitopo immunodominante della proteina di superficie esterna A diBorrelia burgdorferi che mostra una grande omologia dell'antigene-1 associato alla funzione linfocitaria umana, una molecola di adesione della famiglia delle due integrine [ 161 ]. Sebbene questa omologia abbia suscitato preoccupazione per la sicurezza di questo vaccino, non vi sono prove di un'aumentata frequenza dell'artrite nei soggetti che hanno ricevuto il vaccino Lyme [ 162 ]; (3) informazioni indicative possono essere ottenute attraverso l'uso di modelli sperimentali ad hoc di malattie autoimmuni. Diverse formulazioni e adiuvanti vaccinali possono essere confrontati rispetto alla loro potenziale capacità di indurre o migliorare l'espressione della patologia nei modelli rilevanti; (4) indagini immunologiche appropriate, ad esempio la sierologia autoimmune, possono essere sistematicamente incluse negli studi clinici di fase I-III.
In conclusione, la sorveglianza clinica di potenziali effetti avversi autoimmuni e appropriati test di laboratorio dovrebbe essere presa in considerazione per l'inclusione nel protocollo di monitoraggio. Tale sorveglianza dovrebbe essere estesa attraverso la fase di postmarketing qualora si debbano escludere specifici eventi rari [ 10 ].
Rapporti sulle reazioni autoimmuni dopo la vaccinazione costituirebbero probabilmente meno dello 0,01% di tutte le vaccinazioni eseguite in tutto il mondo, anche se questo tasso potrebbe essere parziale di insufficienza di segnalazione.
Abbiamo riportato una sintesi delle valutazioni epidemiologiche, e le conclusioni di causalità per i principali vaccini descritti in questa recensione, tra cui l'epatite A, l'epatite B, l'influenza, MMR, vaccino contro l'HPV (tabelle (Tables5,5 , 6,6 , 7 ,7 , , 8,8 , e and99 ).
Tabella 5
Una sintesi delle valutazioni epidemiologiche e conclusioni sulla causalità per il vaccino contro l'epatite A.
| Digitare il vaccino | Evento avverso | Valutazione epidemiologica | Studi che contribuiscono alla valutazione epidemiologica | Conclusione di causalità |
|---|---|---|---|---|
| Vaccino contro l'epatite A | Mielite trasversa | Insufficiente | Nessuna | insufficiente |
| SIGNORINA | Insufficiente | Nessuna | insufficiente | |
| Sindrome di Guillain Barre | Insufficiente | Nessuna | insufficiente | |
| Polineuropatia infiammatoria cronica disseminata | Insufficiente | Nessuna | insufficiente | |
| Epatite autoimmune | insufficiente | Nessuna | insufficiente |
Tabella 6
Una sintesi delle valutazioni epidemiologiche e conclusioni sulla causalità per il vaccino contro l'epatite B
| Digitare il vaccino | Evento avverso | Valutazione epidemiologica | Studi che contribuiscono alla valutazione epidemiologica | Conclusione di causalità |
|---|---|---|---|---|
| Vaccino contro l'epatite B. | Mielite trasversa | Insufficiente | Nessuna | insufficiente |
| Neurite ottica | Limitato | 2 | insufficiente | |
| Insorgenza di MS negli adulti | Limitato | 4 | insufficiente | |
| Insorgenza di MS nei bambini | Limitato | 1 | insufficiente | |
| Recidiva della SM negli adulti | Limitato | 1 | insufficiente | |
| Recidiva della SM nei bambini | Limitato | 1 | insufficiente | |
| Primo evento demielinizzante negli adulti | Moderare | 3 | insufficiente | |
| Primo evento demielinizzante nei bambini | Limitato | 1 | insufficiente | |
| Sindrome di Guillain Barre | Insufficiente | Nessuna | insufficiente | |
| Polineuropatiainfiammatoria cronica disseminata | Insufficiente | Nessuna | insufficiente | |
| Insorgenza o esacerbazione dell'artrite reumatoide | Limitato | 1 | insufficiente | |
| Diabete di tipo 1 | Moderare | 1 | insufficiente | |
| fibromialgia | Insufficiente | Nessuna | insufficiente |
Tabella 7
Una sintesi delle valutazioni epidemiologiche, delle valutazioni meccanicistiche e delle conclusioni sulla causalità per il vaccino antinfluenzale
| Digitare il vaccino | Evento avverso | Valutazione epidemiologica | Studi che contribuiscono alla valutazione epidemiologica | Conclusione di causalità |
|---|---|---|---|---|
| Vaccino antinfluenzale | Mielite trasversa | Insufficiente | Nessuna | insufficiente |
| Neurite ottica | Limitato | 2 | insufficiente | |
| Insorgenza di MS negli adulti | Limitato | 2 | insufficiente | |
| Sindrome di Guillain Barre | Moderare | 9 | insufficiente | |
| Polineuropatia infiammatoria cronica disseminata | Insufficiente | Nessuna | insufficiente | |
| fibromialgia | Insufficiente | Nessuna | insufficiente |
Tabella 8
Una sintesi delle valutazioni epidemiologiche, delle valutazioni meccanicistiche e delle conclusioni sulla causalità per il vaccino MMR
| Digitare il vaccino | Evento avverso | Valutazione epidemiologica | Studi che contribuiscono alla valutazione epidemiologica | Conclusione di causalità |
|---|---|---|---|---|
VaccinoMMR | Mielite trasversa | Insufficiente | Nessuna | insufficiente |
| Neurite ottica | Limitato | 1 | insufficiente | |
| Insorgenza di MS negli adulti | Limitato | 2 | insufficiente | |
| Insorgenza di MS nei bambini | Limitato | 1 | insufficiente | |
| Sindrome di Guillain Barre | Insufficiente | Nessuna | insufficiente | |
| Polineuropatiainfiammatoria cronica disseminata | Insufficiente | Nessuna | insufficiente | |
| Artrite cronica nelle donne | Limitato | 2 | insufficiente | |
| Diabete di tipo 1 | alto | 5 | Favorisce il rifiuto | |
| fibromialgia | Insufficiente | Nessuna | insufficiente |
Tabella 9
Un sommario delle valutazioni epidemiologiche, delle valutazioni meccanicistiche e delle conclusioni sulla causalità per il vaccino HPV
| Digitare il vaccino | Evento avverso | Valutazione epidemiologica | Studi che contribuiscono alla valutazione epidemiologica | Conclusione di causalità |
|---|---|---|---|---|
VaccinoHPV | Mielite trasversa | Insufficiente | Nessuna | insufficiente |
| Neuromielite ottica | Insufficiente | Nessuna | insufficiente | |
| SIGNORINA | Insufficiente | Nessuna | insufficiente | |
| Sindrome di Guillain Barre | Insufficiente | Nessuna | insufficiente | |
| Polineuropatia infiammatoria cronica disseminata | Insufficiente | Nessuna | insufficiente | |
| Sclerosi laterale amiotrofica | insufficiente | Nessuna | insufficiente | |
| Artralgia transitoria | limitato | 1 | insufficiente |
Inoltre, molte di queste reazioni sono lievi e autolimitate. Tuttavia, dovremmo essere cauti, specialmente non solo nei casi con precedenti fenomeni di post-vaccinazione e quelli con allergie ma anche in individui che sono inclini a sviluppare malattie autoimmuni, come quelli con una storia familiare di autoimmunità o con autoanticorpi noti, e in individui predisposti genetici. In tali sottogruppi, il potenziale beneficio della vaccinazione deve essere valutato rispetto al suo potenziale rischio [ 138 ].
Nel 2015, Soriano et al. supposto che quattro gruppi di individui siano a rischio: (1) pazienti con precedenti fenomeni autoimmuni post-vaccinazione, come i pazienti che hanno manifestato manifestazioni cliniche iniziali (febbre, artralgia) dopo la vaccinazione con dose; (2) pazienti immunosoppressi con condizioni autoimmuni: in effetti, vaccini vivi inclusi BCG, vaccini MMR e vaccini contro l'herpes zoster e febbre gialla sono generalmente controindicati in questi pazienti a causa del rischio di una replicazione virale incontrollata [ 163]; (3) pazienti con una storia di reazioni allergiche: i componenti del vaccino includono potenziali allergeni come proteine derivate da animali come l'uovo (presente nella febbre gialla, l'influenza e vaccini MMR), coadiuvanti come l'alluminio (presente in HPV, HNI e HBV e vaccini) e thimerosal (vaccino HPV), antibiotici come gentamicina, neomicina, streptomicina, polimixina B e stabilizzanti come la gelatina (presente in varicella e vaccini MMR) e lattosio; (4) pazienti che sono inclini a sviluppare autoimmunità, compresi i pazienti con una storia familiare di malattie autoimmuni; portatori asintomatici di autoanticorpi, come alti livelli di anticorpi anti-proteina citrullinata (ACPA) in RA, anticorpi anti-mitocondriale (AMA) nella cirrosi biliare primitiva, anticorpi anti-tiroide nella tiroidite di Hashimoto e anti-dsDNA in SLE [ 164]; portando alcuni profili genetici, compresi i pazienti con polimorfismi associati al gene dell'insulina, il gene della tireoglobulina e il gene del recettore dell'ormone stimolante la tiroide [ 165 ].
Conclusioni e raccomandazioni di esperti
La vaccinazione potrebbe mostrare effetti collaterali autoimmuni e potenzialmente persino scatenare una malattia autoimmune in piena regola. Questa suscettibilità all'autoimmunità indotta dal vaccino è probabilmente determinata anche dalla predisposizione genetica, che sottolinea ulteriormente l'importanza del "mosaico di autoimmunità" [ 4 ]. La vaccinazione riduce la morbilità e la mortalità degli individui, specialmente dei bambini. Tuttavia, il dilemma di chi e quando vaccinare rimane irrisolto e sono necessarie ulteriori ricerche per spiegare il meccanismo di azione.
Infine, crediamo che il nostro impegno dovrebbe essere quello di pianificare le indagini genetiche sui pazienti affetti da autoimmunità post vaccinazione al fine di chiarire il background patogeno e la fisiopatologia della risposta autoimmune correlata al vaccino. Si spera che questo approccio possa condurre a delineare uno screen-test (patch test?) Per questo rischio e, alla fine, alla prevenzione delle reazioni avverse mediante vaccinazione. Potrebbe rappresentare una "medicina personalizzata" che potrebbe potenzialmente migliorare i metodi preventivi e le opzioni terapeutiche, di conseguenza con le raccomandazioni dell '"Associazione europea per la medicina predittiva, preventiva e personalizzata" [ 166].
Conformità agli standard etici
finanziamento
Questo studio non è finanziato.
Conflitto d'interesse
Gli autori dichiarano di non avere conflitti di interesse.
Tratto da: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5607155/
La sindrome di Sjögren (SS), una condizione infiammatoria autoimmune sistemica cronica che coinvolge le ghiandole esocrine, è stata suggerita come parte dello spettro della sindrome autoimmune / infiammatoria indotta dagli adiuvanti (ASIA). ASIA incorpora un ombrello di condizioni cliniche tra cui la siliconosi, la sindrome della miofascite dei macrofagi e i fenomeni di post-vaccinazione che si verificano dopo l'esposizione a una sostanza, vale a dire l'adiuvante. È interessante notare che SS e ASIA condividono diverse caratteristiche comuni. In primo luogo, è stato proposto un meccanismo patogenetico condiviso che comporta un'interruzione dell'equilibrio del sistema immunitario, con proliferazione delle cellule B, produzione di citochine e infiltrazione tissutale. I pazienti con ASIA presentano spesso caratteristiche cliniche simili a quelle della SS; bocca asciutta e occhi asciutti sono stati inclusi nei criteri di classificazione proposti per ASIA. Finalmente, diversi case report hanno suggerito che sia i vaccini che il silicone potrebbero innescare lo sviluppo di SS. Svelare questi percorsi comuni contribuirà notevolmente alla nostra comprensione e gestione di entrambe le condizioni.
Tratto da: https://www.ncbi.nlm.nih.gov/pubmed/27228631
https://informaresenzacensure.blogspot.com/2018/12/la-narrativa-che-i-vaccini-stanno.html
2016
Sindrome autoimmune / infiammatoria indotta dagli adiuvanti e dalla sindrome di Sjögren.
Astratto
Tratto da: https://www.ncbi.nlm.nih.gov/pubmed/27228631
Fonte alternativa: http://vaccinesafetycommission.org/pdfs/03-2016-IMAJ-ISRAEL.pdf
Articoli Correlati:
La narrativa che i vaccini stanno mantenendo i bambini sani si sta rapidamente sgretolando. Negli Stati Uniti i tassi di malattia cronica e autoimmune sono salite del 54% in concomitanza all'aumento dei tassi di vaccinazioneArticoli Correlati:
https://informaresenzacensure.blogspot.com/2018/12/la-narrativa-che-i-vaccini-stanno.html

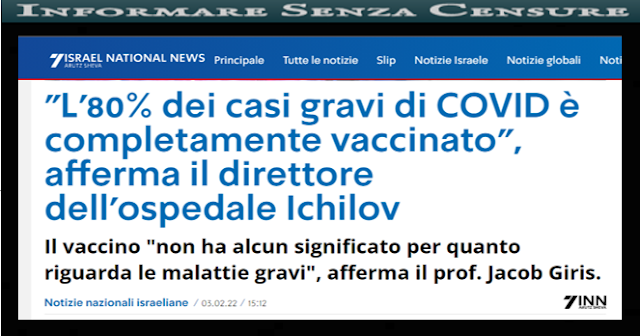



sono assassini
RispondiElimina