Il BMJ mette in discussione la trasparenza delle informazioni relative alla sicurezza del vaccino "influenza suina" di Pandemrix
-Una serie di rapporti interni di GlaxoSmithKline suggerisce la possibilità che sia emerso un grave segnale riguardo la sicurezza per Pandemrix durante le campagne vaccinali H1N1 2009
-I dati hanno indicato ampie discrepanze nel tasso di segnalazione degli eventi avversi per Pandemrix rispetto ad altri vaccini anti-influenzali pandemici GSK
-Il produttore e alcuni enti sanitari hanno ricevuto segnalazioni ma non li hanno resi pubblici.....
20 Settembre 2018
Nell'ottobre del 2009, il capo delle malattie infettive del National Institutes of Health degli Stati Uniti, Anthony Fauci, è apparso su YouTube per rassicurare gli americani sulla sicurezza del vaccino contro l'influenza suina. "Il track record per eventi avversi gravi è molto buono. E 'molto, molto, molto raro che avete mai visto qualcosa che è associato con il vaccino che è un evento serio” 1 , ha detto.
Quattro mesi prima, l'Organizzazione Mondiale della Sanità aveva dichiarato l'influenza H1N1 una pandemia e nell'ottobre 2009 i nuovi vaccini venivano lanciati in tutto il mondo. Una storia simile si stava svolgendo nel Regno Unito, con organizzazioni di spicco, tra cui il Dipartimento della Sanità, la British Medical Association e le Royal Colleges of General Practitioners, lavorando sodo per convincere una riluttante forza lavoro del NHS a farsi vaccinare. 2 "Sosteniamo pienamente il programma di vaccinazione contro l'influenza suina ... Il vaccino è stato accuratamente testato", hanno dichiarato in una dichiarazione congiunta. 3
Tranne che no. Anticipando una grave pandemia influenzale, i governi di tutto il mondo avevano adottato varie disposizioni logistiche e giuridiche per ridurre il tempo tra il riconoscimento di un virus pandemico e la produzione di un vaccino e la somministrazione di tale vaccino nella popolazione. In Europa, un elemento di questi piani era un accordo per concedere licenze a vaccini pandemici basati su dati di vaccini "mock-up" pre-pandemici prodotti usando un virus diverso (influenza H5N1). Un altro elemento, adottato da paesi come il Canada, gli Stati Uniti, il Regno Unito, la Francia e la Germania, era quello di fornire all'industria dei vaccini l'indennizzo dalla responsabilità per i trasgressori, riducendo così il rischio di una causa derivante da lesioni correlate al vaccino. 4 5
In un'intervista rilasciata a The BMJ , Liam Donaldson, allora chief medical officer in Inghilterra, ha ricordato la situazione intorno al roll-out dell'ottobre 2009: "Il Regno Unito aveva lavorato per diversi anni sui suoi piani di influenza pandemica, come parte di un approccio coordinato a livello globale . Ciò includeva, con largo anticipo, la definizione del processo per lo sviluppo e l'introduzione di un vaccino in tale emergenza sanitaria pubblica.
"Di fronte a una pandemia emergente di gravità sconosciuta, il processo è stato avviato. Il comitato scientifico nazionale per i vaccini (JCVI) e le autorità di regolamentazione dei medicinali legali sono stati pienamente coinvolti nelle fasi procedurali che hanno portato all'introduzione e all'uso del vaccino. Questa non era una decisione politica presa in assenza di tale competenza ", ha detto.
Controversia
I vaccini contro l'influenza sono probabilmente gli unici vaccini che una parte notevole degli operatori sanitari declina nonostante le raccomandazioni. 6 E alla fine del 2009, i vaccini contro l'influenza suina H1N1 - che si stava rivelando una pandemia molto più blanda di quanto avevano previsto i funzionari - erano persino più controversi del normale.
In Germania, i medici senior hanno espresso dubbi sul vaccino Pandemrix di GlaxoSmithKline. Erano preoccupati per i potenziali effetti collaterali innescati dall'adiuvante AS03, un'emulsione olio-in-acqua che conteneva per aumentare l'efficacia. 7 Poi scoppiò la polemica quando il quotidiano tedesco Der Spiegel riferì che politici e impiegati governativi di alto livello avrebbero ricevuto Celvapan, il vaccino non alluvionato H1N1 di Baxter, non Pandemrix. 7
Le preoccupazioni, a quanto pare, erano preveggenti. Un anno dopo, i segni di un problema con Pandemrix stavano emergendo attraverso i rapporti post-vendita di narcolessia, prevalentemente tra bambini e adolescenti in Svezia e Finlandia. 8 Diversi studi condotti a livello accademico e governativo hanno successivamente giudicato che la relazione tra Pandemrix e narcolessia poteva essere causale. 9 10 11 Si stima che oltre 1300 persone siano state colpite da circa 30 milioni di persone vaccinate in tutta Europa, 12 incluse circa 100 famiglie nel Regno Unito. 13
Tuttavia, GSK e l'Agenzia europea per i medicinali, che ha concesso in licenza Pandemrix, non hanno accettato che l'associazione con la narcolessia si sia dimostrata causale, e la ricerca sull'argomento continua. 14 GSK ha dichiarato al BMJ che "sono necessarie ulteriori ricerche per confermare quale ruolo potrebbe aver avuto Pandemrix nello sviluppo della narcolessia tra le persone colpite".
Seguirono richieste di risarcimento, con molte ancora combattute nei tribunali. 15
Ora, otto anni dopo l'epidemia, stanno emergendo nuove informazioni da una delle cause che, mesi prima che fossero riportati i casi di narcolessia, il produttore e i funzionari della sanità pubblica erano a conoscenza di altri gravi eventi avversi registrati in relazione a Pandemrix.
Problema non dichiarato
Nei documenti ottenuti attraverso il processo di scoperta preliminare (si vedano i dati supplementari su bmj.com), i pubblici ministeri che hanno fatto causa al ministro irlandese della sanità, al dirigente sanitario, all'organo normativo per i prodotti sanitari e GSK hanno trovato una serie di rapporti di sicurezza postmarketing di GSK che mostrano un sorprendente differenza nel numero e nella frequenza degli eventi avversi segnalati per tre vaccini pandemici GSK approvati e utilizzati in tutto il mondo: Pandemrix, Arepanrix, un vaccino H1N1 simile che conteneva anche adiuvante AS03 e un vaccino H1N1 senza adiuvante (non viene fornito alcun marchio).
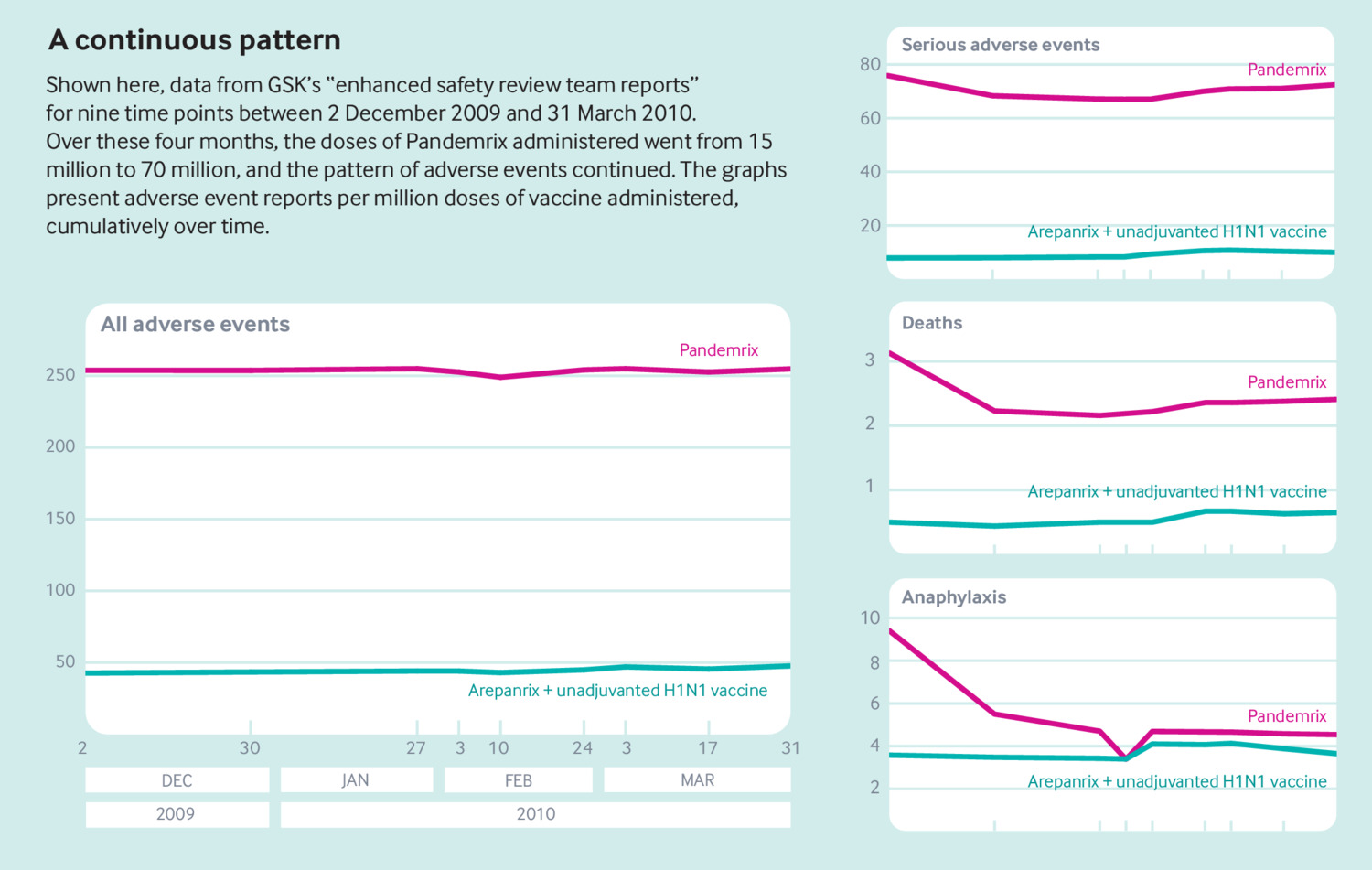
Il BMJ ha appreso delle relazioni del mio collega Tom Jefferson, un epidemiologo formato da personale medico che è stato assunto come testimone esperto dagli avvocati che rappresentano Aoife Bennett, una donna irlandese che ha sviluppato la narcolessia dopo la vaccinazione con Pandemrix nel 2009. Jefferson ha assunto il caso nel 2015 e l'anno scorso gli avvocati hanno ricevuto una copia dei rapporti di sicurezza GSK che erano stati inviati via email all'interno dell'azienda e ad almeno un regolatore (Irlanda). Le tabelle degli eventi avversi incorporate in nove rapporti che coprono i quattro mesi tra dicembre 2009 e marzo 2010 offrono uno sguardo ai profili di sicurezza dei vaccini.
"Quando ho visto quei tavoli, sono semplicemente caduto dalla sedia. Un consumatore può capire cosa sta succedendo qui ", mi ha detto Jefferson (tabella 1).
Tabella 1
Riproduzione della tabella dei rapporti sugli eventi avversi dal rapporto interno GSK del 2 dicembre 2009 *
Jefferson ha calcolato immediatamente i tassi di eventi avversi per ciascun vaccino, che mostravano grandi differenze tra Pandemrix e Arepanrix. Qualsiasi reale differenza tra i vaccini sarebbe particolarmente allarmante perché Pandemrix e Arepanrix sono, in generale, lo stesso vaccino prodotto in diverse strutture e utilizzato in diversi paesi. I tassi divergenti di eventi avversi potrebbero implicare un problema di fabbricazione.
"I rapporti di quota, le stime puntuali, sono tutti alti. E alcuni di questi sono significativamente alti 5,39 [intervallo di confidenza al 95% da 3,70 a 7,85] per decessi [per Pandemrix contro gli altri vaccini] ", ha detto Jefferson.
"La cosa che mi ha colpito non era solo il fatto che i rapporti di probabilità fossero alti, ma il fatto che nessuno li avesse analizzati e analizzati", ha detto, sottolineando che i rapporti GSK fornivano dati numeratori e denominatori sufficienti per calcolare i rapporti di probabilità, ma lo hanno fatto in realtà non contengono quei calcoli.
Il BMJ ha condotto la propria analisi degli eventi avversi, molti dei quali sembrano essere stati segnalati spontaneamente a GSK ( figg. 1 e 2 ). Per una serie di eventi avversi correlati, i rapporti per Pandemrix erano costantemente più alti rispetto agli altri due vaccini pandemici GSK: quattro volte il tasso di paralisi facciale, otto volte il tasso di eventi avversi gravi, nove volte il tasso di convulsioni. Complessivamente, Pandemrix ha avuto, proporzionalmente, cinque volte più eventi avversi segnalati rispetto ad Arepanrix e al vaccino non adiuvato.
Fig. 1
Segnalazioni di eventi avversi (numero / milione di dosi) per i vaccini contro l'influenza pandemica GSK fino al 2 ottobre 2009 (GSK riporta il numero di dosi per Arepanrix e il vaccino non adiuvante insieme)
Fig 2
Tasso cumulativo di eventi avversi (numero / milione di dosi) per i vaccini influenzali pandemici nel tempo, da dicembre 2009 a marzo 2010
E il numero grezzo di eventi avversi non era piccolo. Anche se si dice spesso che solo fino al 10% degli eventi avversi sono segnalati ai sistemi nazionali di segnalazione, 16 alla fine di novembre, GSK ha ricevuto 1138 segnalazioni di eventi avversi gravi per Pandemrix - un tasso di 76 per milione di dosi somministrate. A metà dicembre, c'erano stati 3280 segnalazioni di eventi avversi gravi (68 / milioni di dosi). L'ultimo rapporto visto da The BMJ , datato 31 marzo 2010, mostra 5069 eventi avversi gravi per Pandemrix (72 / milioni di dosi), sette volte il tasso di Arepanrix e il vaccino non adiuvato combinato.
I dati non sono sufficienti per trarre conclusioni su causa ed effetto, ma per Gillian O'Connor, l'avvocato che rappresenta Bennett, sollevano serie domande sulla trasparenza. La disparità, ha scritto in una dichiarazione giurata depositata in tribunale, è stata "di una tale straordinaria differenza che chiunque abbia intenzione di prendere il vaccino Pandemrix sarebbe probabilmente, se ricevesse questa informazione, non scegliere di avere la vaccinazione Pandemrix".
Campanelli d'allarme che non hanno mai suonato
Ma né GSK né le autorità sanitarie sembrano aver reso pubbliche le informazioni, né è chiaro che la disparità sia stata indagata. Ciò è in contrasto con la reazione alla narcolessia, che ha rapidamente fatto notizia e che è stata oggetto di un comunicato stampa e di un'inchiesta della GSK 17 in poche settimane dopo i primi rapporti di Svezia e Finlandia.
In molti dei rapporti GSK, l'azienda menziona brevemente di aver condotto "analisi di sicurezza", ad esempio, per quanto riguarda anafilassi, paralisi facciale e sindrome di Guillain-Barré. Il BMJ ha chiesto a GSK una copia di quelle recensioni ma non le ha fornite.
In una dichiarazione, GSK ha scritto: "Dopo l'introduzione di Pandemrix, GSK ha continuamente valutato tutti i dati di sicurezza disponibili e condiviso i dati con l'EMA e altre autorità di regolamentazione in cui il vaccino è stato concesso in licenza in modo che le autorità potessero condurre le proprie valutazioni indipendenti. L'EMA ha effettuato riepiloghi settimanali dei dati forniti da GSK e altri produttori pubblicamente accessibili e rimangono accessibili attraverso il sito web dell'EMA. "
Il BMJ ha chiesto a GSK se ha mai intrapreso qualche indagine per comprendere la discrepanza nella segnalazione degli eventi avversi tra Pandemrix e Arepanrix, se ha informato i fornitori di assistenza sanitaria in merito alle discrepanze, se ha preso in considerazione la possibilità di estrarre Pandemrix dal mercato o se ha ritenuto di raccomandare Arepanrix o il vaccino di un'altra azienda. Ma GSK ha rifiutato di rispondere a queste e tutte le domande di The BMJ , citando un contenzioso in corso.
Il BMJ ha chiesto al Dipartimento della Salute del Regno Unito perché ha raccomandato Pandemrix rispetto a Celvapan di Baxter, ma il dipartimento ha anche rifiutato di commentare, definendo la domanda "abbastanza tecnica" e suggerendo di presentare una richiesta di libertà di informazione per una risposta.
Nel dicembre 2009 i manifestanti in Scozia sono scesi in strada per sfidare la campagna di vaccinazione contro il virus dell'influenza suina del governo sostenendo che non era in linea con la lieve pandemia. 18
"Catastrofe evitabile"
Il programma di vaccinazione è proseguito anche in Irlanda. "Il governo irlandese ha continuato a invitare le persone a farsi vaccinare", ha osservato Jefferson. "Questo era quando era abbastanza chiaro che la pandemia era in declino e non era neanche lontanamente la catastrofe ritratta da ricercatori, governi, industria e media influenzati".
Clare Daly, membro del parlamento irlandese, ha definito gli eventi avversi dopo Pandemrix una "catastrofe completamente evitabile" e ha chiesto risposte per oltre un anno. 19 Nell'assemblea nazionale irlandese dello scorso anno, ha detto all'allora primo ministro, Enda Kenny, "L'Health Service Executive (HSE) ha deciso di acquistare Pandemrix e ha continuato a distribuirlo anche dopo aver saputo che era pericoloso e non testato, e prima della maggior parte il pubblico in Irlanda lo ha ricevuto. " 20 In risposta, il Taoiseach ha affermato che le preoccupazioni sulla sicurezza di Pandemrix e le azioni di GSK meritano" analisi immediate ". Il BMJ ha richiesto un aggiornamento sull'indagine del Dipartimento della Sanità irlandese ma non ha ricevuto una risposta diretta
Quello che EMA sapeva - o avrebbe potuto sapere - sulla sicurezza comparativa dei vaccini pandemici della GSK è difficile da comprendere. Ha dichiarato a The BMJ che "l'EMA non effettua valutazioni comparative di benefici e rischi tra prodotti approvati nell'UE, o tra prodotti e prodotti UE approvati o utilizzati al di fuori dell'UE".
Ma, se lo avesse voluto, l'agenzia aveva i dati per condurre una simile analisi? Nonostante la somiglianza tra i due vaccini, Arepanrix non è stato autorizzato nell'UE fino a marzo 2010, in ritardo nella pandemia, e i requisiti di segnalazione dei dati per i due vaccini erano diversi.
"Anche se sarebbe stato possibile stimare i tassi di segnalazione in base ai dati di utilizzo, difficili da ottenere durante una pandemia, l'EMA non ha una metodologia per confrontare i tassi di segnalazione tra due prodotti (si noti che gli aggiornamenti di farmacovigilanza dell'influenza pandemica includevano il numero di segnalazioni , non i tassi) ", ha detto un portavoce EMA.
Jefferson non è stato coinvolto. "Qual è lo scopo della farmacovigilanza se nessuno sta agendo sulle informazioni? Questa informazione ha richiesto otto anni per venire alla luce attraverso il lavoro accademico e il contenzioso. È accettabile? Se le informazioni a nostra disposizione sono parziali, questa è la conseguenza diretta della segretezza, che non dovrebbe circondare alcun intervento di sanità pubblica ".
Pandemrix e Arepanrix sono stati progettati per una pandemia e sono stati rimossi dai mercati globali dopo la pandemia. Quali che siano gli eventi avversi che possono aver causato, sono vaccini del passato. Ma gli eventi del 2009-10 sollevano questioni fondamentali sulla trasparenza delle informazioni. Quando i funzionari della sanità pubblica hanno il dovere di avvertire il pubblico in merito ai possibili danni dei vaccini rilevati attraverso la farmacovigilanza? Quanti dettagli dovrebbe essere fornito al pubblico, chi dovrebbe fornirlo e se la fornitura di tali informazioni sia proattiva o passiva?
Se la storia dovesse ripetersi, il pubblico ha il diritto di sapere?
Le note
- Interessi competitivi: ho letto e compreso la politica di BMJ sulla dichiarazione di interessi e dichiaro di essere un collega di Tom Jefferson, citato in questa storia.
- Provenienza e peer review: Commissionato; peer esterni revisionati.
Tratto da: https://www.bmj.com/content/362/bmj.k3948
Articoli Correlati:Se Questa è L'OSM.....
http://informaresenzacensure.blogspot.com/2018/03/se-questa-e-losm.htmlVaccini: Bridget Sullivan la mamma che ha combattuto con il governo per otto anni dopo che suo figlio, James, è stato vittima di alcuni degli altri effetti collaterali mortali dopo aver ricevuto il vaccino Pandemrix.
http://informaresenzacensure.blogspot.com/2018/08/vaccini-bridget-sullivan-la-mamma-che.htmlVaccini: Dominic Vaz di Kinnegad, ho contratto la narcolessia dopo aver ricevuto il vaccino Pandemrix da adolescente fa causa allo Stato
http://informaresenzacensure.blogspot.com/2018/05/vaccini-dominic-vaz-di-kinnegad-ho.htmlVaccini: QUELLI PULITI E SICURI SONO SOLO PER L' ELITE'
http://informaresenzacensure.blogspot.com/2018/09/vaccini-quelli-puliti-e-sicuri-sono.htmlMessico: il governo ha stanziato 5 milioni di euro per le vittime dell'effetto collaterale del vaccino Pandemrix
http://informaresenzacensure.blogspot.com/2018/09/messico-il-governo-ha-stanziato-5.html


Nessun commento:
Posta un commento